
题目列表(包括答案和解析)
| A.氯化钠 | B.碳酸钠 | C.二氧化碳 | D.生石灰 |
碳酸钠,化学式Na2CO3,俗称纯碱.“纯碱中常常会混有少量的氯化钠”.某研究性学习小组以一包纯碱(若有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的含量.请你参与他们的活动.
[小组讨论]
观点Ⅰ:纯碱样品中只含有碳酸钠
观点Ⅱ:纯碱样品是由碳酸钠和少量氯化钠组成的混合物
[实验设计]
甲方案
Ⅰ设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ操作步骤:称取13.25 g纯碱样品,加入过量的澄清石灰水,充分搅拌.过滤、洗涤、干燥,得到白色沉淀10.00 g
Ⅲ数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
Ⅳ实验结论:________.
乙方案
Ⅰ设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ实验结论:
(1)当a、b的质量关系满足________(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100﹪.
(2)当a、b的质量关系满足________时,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是________.
[实验评价]
误差分析:(1)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.(2)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比________(填写“偏大”、 “偏小”或“不变”).
[交流反思]
(1)实验过程中,需用玻璃棒不断搅拌,该操作的目的是________.
(2)甲方案实验操作中,对沉淀洗涤的目的是:________.
(3)乙方案中,需用一定质量的19.6﹪的稀硫酸.现有一瓶98﹪的浓硫酸(密度为1.84 g/cm3),配制乙方案中实验所用稀硫酸,至少需要浓硫酸的体积是________mL(填写含字母的表达式).浓硫酸稀释的正确操作是________.
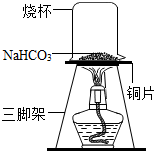 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 固体产物是Na2CO3,而不是NaOH | |
| 实验三: |
产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com