
题目列表(包括答案和解析)
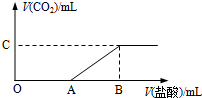 标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后得溶液M(无CO2存在).在溶液M中逐滴缓慢滴加1mol/L盐酸,生成气体的体积与所加盐酸的体积关系如图所示:
标准状况下,向100mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后得溶液M(无CO2存在).在溶液M中逐滴缓慢滴加1mol/L盐酸,生成气体的体积与所加盐酸的体积关系如图所示:| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 (填写化学式) |
① NaHCO3 NaHCO3 |
② Na2CO3和NaHCO3 Na2CO3和NaHCO3 |
③ Na2CO3 Na2CO3 |
④ NaOH和Na2CO3 NaOH和Na2CO3 |
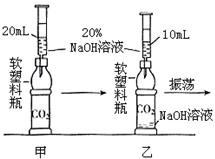 (2010?长沙)将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.
(2010?长沙)将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com