
题目列表(包括答案和解析)

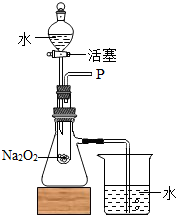 (2013?德宏州)某同学在表演完“水能生火”的魔术后解释说:“该魔术是向包有淡黄色过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱胎棉就能燃烧起来.”小红听完后以这个“魔术”非常感兴趣,她和同学们一起对该问题进行了探究.
(2013?德宏州)某同学在表演完“水能生火”的魔术后解释说:“该魔术是向包有淡黄色过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱胎棉就能燃烧起来.”小红听完后以这个“魔术”非常感兴趣,她和同学们一起对该问题进行了探究.| 实验步骤 | 实验现象 | 实验结论 |
| ①取由白色固体配制成的溶液少许于试管中,加入过量的稀盐酸 | 没有气泡产生 | 生成物中 无碳酸钠 生成物中 无碳酸钠 |
| ②再取由白色固体配制成的溶液少许于试管中,加入适量的CuCl2溶液 | 生成蓝色沉淀 生成蓝色沉淀 |
生成物为NaOH |


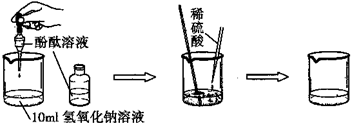
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com