
题目列表(包括答案和解析)
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |




| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |


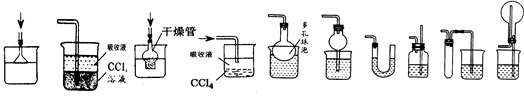
| 消毒剂 | 化学式 | 性质和用途 | 注意事项 |
| 过氧乙酸溶液 | CH3COOOH | 过氧乙酸易挥发、易分解,其分解产物为醋酸和氧气.过氧乙酸具有很强的消毒杀菌能力,可以迅速杀灭各种微生物,包括病菌、细菌等 | 对皮肤有 腐蚀作用 |
| 双氧水 | H2O2 | 过氧化氢溶液俗称为双氧水,是一种无色液体,容易分解,其分解产物为水和氧气.双氧水具有较强的消毒杀菌能力. | 需低温 避光保存 |
| 消毒剂 | 化学式 | 性质和用途 | 注意事项 |
| 过氧乙酸溶液 | CH3COOOH | 过氧乙酸易挥发、易分解,其分解产物为醋酸和氧气.过氧乙酸具有很强的消毒杀菌能力,可以迅速杀灭各种微生物,包括病菌、细菌等 | 对皮肤有 腐蚀作用 |
| 双氧水 | H2O2 | 过氧化氢溶液俗称为双氧水,是一种无色液体,容易分解,其分解产物为水和氧气.双氧水具有较强的消毒杀菌能力. | 需低温 避光保存 |
| 消毒剂 | 化学式 | 性质和用途 | 注意事项 |
| 过氧乙酸溶液 | CH3COOOH | 过氧乙酸易挥发、易分解,其分解产物为醋酸和氧气.过氧乙酸具有很强的消毒杀菌能力,可以迅速杀灭各种微生物,包括病菌、细菌等 | 对皮肤有 腐蚀作用 |
| 双氧水 | H2O2 | 过氧化氢溶液俗称为双氧水,是一种无色液体,容易分解,其分解产物为水和氧气.双氧水具有较强的消毒杀菌能力. | 需低温 避光保存 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com