
题目列表(包括答案和解析)

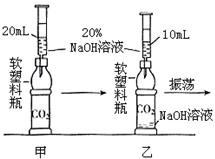 34、将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了看到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.
34、将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了看到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.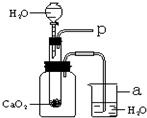 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.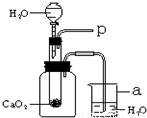

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com