请你参与下列探究.
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时,有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体呢?
[提出猜想]从物质组成元素的角度分析,放出的气体可能是SO
2、O
2、H
2.
[查阅资料]SO
2易溶于水,它能与NaOH溶液反应,生成Na
2SO
3.
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O
2,则检验方法是______.
(2)乙同学认为是SO
2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO
2与NaOH反应的化学方程式:______.
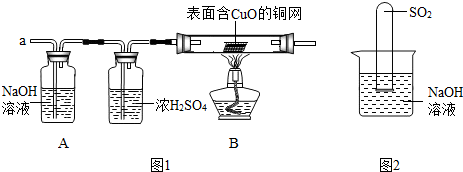
(3)实验小组同学合作设计了如图1组合实验方案,排除和验证猜想的气体.
如果放出的是O
2和H
2的混合物,你认为方案中的安全隐患是______.
丙同学认为:为确保安全,实验前应先进行验纯操作.
[实验探究]经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量不变.
结论:
(1)铁粉与硫酸铜溶液反应时,产生的气体是______.
(2)写出该气体与CuO反应的化学方程式:______.
[思维拓展]
(1)由上述实验可以推出,硫酸铜溶液显______(选填“酸”或“碱”)性.
(2)不通过称量,如何判断SO
2与NaOH溶液发生了反应呢?有一同学设计了图2所示的装置进行实验,发现试管内液面上升,就得出SO
2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.