
题目列表(包括答案和解析)
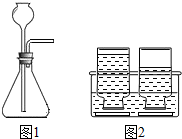
| 实验步骤 | 实验原理、操作及现象 |
| (1)连接仪器 | |
| (2)检查装置的气密性 | 旋紧橡皮塞,用止水夹夹住导气管口,向长颈漏斗中注入水,若长颈漏斗内液面高于锥形瓶内液面,且保持一段时间,则该装置气密性良好(合理均可) 旋紧橡皮塞,用止水夹夹住导气管口,向长颈漏斗中注入水,若长颈漏斗内液面高于锥形瓶内液面,且保持一段时间,则该装置气密性良好(合理均可) |
| (3)加药品:先向250mL锥形瓶中加入颗粒大小差不多的石灰石10块,旋紧橡胶塞后再从长颈漏斗中加盐酸(1:2)25mL | 反应的化学方程式: CaCO3+2HCl═H2O+CO2↑+CaCl2 CaCO3+2HCl═H2O+CO2↑+CaCl2 |
| (4)收集:A组用排水法,B组用向上排空气法,各收集两瓶(250mL)CO2,并记录收集满第一瓶的时间(从倒盐酸时开始计时).正放桌面上备用. | A组观察到 集气瓶内液面下降至瓶口,且有气泡从瓶口冒出 集气瓶内液面下降至瓶口,且有气泡从瓶口冒出 现象时,表明气体已经收集满.B组的验满方法及现象是将燃着的木条放于瓶口,木条熄灭 将燃着的木条放于瓶口,木条熄灭 记录集满第一瓶气体所需要的时间. |
(5)将收集到的两瓶气体分别慢慢倒入放有燃着的蜡烛的烧杯中,如图所示,观察现象.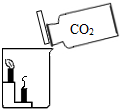 |
下面的蜡烛先熄灭,上面的蜡烛后熄灭 下面的蜡烛先熄灭,上面的蜡烛后熄灭 |
| 分工 | A大组(排水法) | B大组(向上排空气法) | ||||||
| 第一组 | 第二组 | 第三组 | 第四组 | 第一组 | 第二组 | 第三组 | 第四组 | |
| 集满气体时间 | 35″ | 43″ | 39″ | 44″3 | 1′15″ | 1′4″ | 1′12″ | 59″ |

| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 ______ | 产生大量的气泡 | 该溶液是______,反应的化学方程式 ______ |
Ⅰ.探究:实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%” 字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究。

提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是 A.酸 B.碱 C.盐
查阅资料:
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3和NaHCO3溶液都呈碱性。
③测定室温(20℃)时,四种物质的溶解度的数据如下:
|
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
|
溶解度g |
36 |
109 |
215 |
9.6 |
得出结论:小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 。
设计实验并继续探究:
①小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是 。
②小强为了确定该溶液是哪种溶液,他又进行了如下实验:
|
操作步骤 |
实验现象 |
结论及化学方程式 |
|
取样于试管中,滴加
|
产生大量的气泡 |
该溶液是 ,反应的化学方程式
|
拓展与应用:确定该溶液还可以选择与小强不同的试剂,你选择的试剂是 (要求类别不同),对应的现象是 。
反思与评价:小淇认为上述探究存在问题,她的理由是 。
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g·mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如右下图所示的关系,
求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)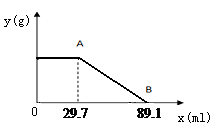
(4)
某学习小组对在实验中吸收过二氧化碳气体的碱石灰成分进行了研究.
【查阅资料】
①碱石灰是CaO与NaOH 的固体混合物,通常用于吸收二氧化碳及干燥气体.
②碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
【提出猜想】
该碱石灰的主要成分可能含有 、Ca(OH)2、CaCO3、NaOH和 .
【设计方案、收集证据】
(1)甲同学在烧杯中放入少量的碱石灰样品,加入足量蒸馏水充分搅拌,静置有白色沉淀,甲同学认为样品中一定含有CaCO3,乙同学认为他的结论不准确,原因是: (填化学方程式).
(2)乙同学进一步设计实验并进行验证,过程如下:
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 溶液. | 有白色沉淀生成 | 生成白色沉淀的化学方程式为: . |
| ②过滤,向滤液中滴加无色酚酞试液. | 无明显现象 | 通过实验及分析,样品中不含有: . |


某学习小组对在实验中吸收过二氧化碳气体的碱石灰成分进行了研究.
【查阅资料】
①碱石灰是CaO与NaOH 的固体混合物,通常用于吸收二氧化碳及干燥气体.
②碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
【提出猜想】
该碱石灰的主要成分可能含有 、Ca(OH)2、CaCO3、NaOH和 .
【设计方案、收集证据】
(1)甲同学在烧杯中放入少量的碱石灰样品,加入足量蒸馏水充分搅拌,静置有白色沉淀,甲同学认为样品中一定含有CaCO3,乙同学认为他的结论不准确,原因是: N (填化学方程式).
(2)乙同学进一步设计实验并进行验证,过程如下:
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 溶液. | 有白色沉淀生成 | 生成白色沉淀的化学方程式为: . |
| ②过滤,向滤液中滴加无色酚酞试液. | 无明显现象 | 通过实验及分析,样品中不含有: . |
【解释与评价】
(1)乙同学进一步设计了下列实验装置,通过称量B装置的质量变化来确定样品的成分及质量(气密性良好,每步均完全反应,操作无误).

多次实验发现测定结果有时偏大有时偏小偏差,试分析其主要原因: .
(2)在老师的指导下乙同学完善了实验装置,并重新进行了实验,步骤如下:
①检查装置气密性,将5.06g干燥的样品放入锥形瓶中;
②打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
③称量盛有氢氧化钠浓溶液的D瓶质量;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤打开活塞b,从导管a处缓缓鼓入一定量的空气;
⑥称量D瓶质量,增重2.2g.
通过分析及计算可知:5.06g样品中各成分及质量 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com