
题目列表(包括答案和解析)
A.n1∶n2>1 B.n1∶n2<1
C.n1∶n2=1 D.无法确定

 、
、 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:


 、
、 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:



一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系 列化工原料和燃料的化学,
(1)工业上用天然气和水蒸气在高温条件下发生
反应,得到CO和H2,该反应的化学方程式为 得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据(1)中所写的化学方程式.合成气中CO和H2的质量比为 。
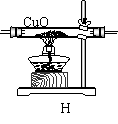
 Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:
Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:
【设计买验步骤]
①连接好装置并检查气密性。
②装入药品,通人一段时间合成气。
③分别称量装置D、E的质量。
④缓缓通入合成气,加热装置C,使其充分反应。
⑤停止加热,继续通入合成气至恢复到室温。
⑥再次分别称量装置D、E的质量。
[完善实验设计]经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤
(填实验步骤的序号)中点燃(点燃前应对气体验纯)。
[进行实验]该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
①装置C中出现 色物质。
②称量数据如右表所示。
[现象分析和数据处理]
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。 .
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO。试通过计算说明他的推测依据。
| 装置D的质量 | 装置E的质量 | |
| 反应前 | 292.4g | 198.2g |
| 反应后 | 296.0g | 201.5g |
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。你认为该误差对乙同学的推测结果是否有影响?
(选填“是”或“否”,并说明理由)。
[拓展探究]该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究。
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;
白色的无水硫酸铜遇水会变成蓝色。
 实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。
 | |||||
 | |||||
 | |||||
F G I
①上图装置F中盛放的试剂名称是 。
②上图装置的正确连接顺序是 (填字母,且每套装置限用一次)。
[实验反思]除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为
(写出一个原因,并说明理由)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com