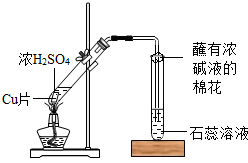
某校化学兴趣小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?他们设计了如下图所示装置进行探究.
[猜想与假设]
①在常温下能反应
②常温下不能反应,但在加热条件下能反应
③在加热条件下不能反应
[查阅资料]
含有Cu
2+的水溶液通常显蓝色
[实验与事实]
操作①将一小块铜片放入试管中,加入足量浓硫酸,无明显现象;
操作②加热该试管,铜片上有气泡,产生了有刺激性气味的气体;
操作③停止加热,将试管中的残液慢慢倒入水中,溶液呈蓝色.
[分析与思考]
(1)甲同学认为,由以上探究可知:猜想
(填序号)是正确的.
(2)乙同学认为,经检验产生的气体是SO
2,所以铜跟浓硫酸在加热条件下反应的产物只是SO
2和CuSO
4.
(3)丙同学认为,在实验装置中,“蘸有浓碱液棉花”的作用是
.
[反思与评价]
(4)操作③中,从安全角度考虑
(填“可以”或“不可以”)将水倒入残液中,其理由是
.
(5)在[分析与思考](2)中对产物只是SO
2和CuSO
4的判断是否准确
(填“是”或“否”),其理由是
.
[拓展与应用]
稀硫酸
O2加热
浓硫酸加热
(6)根据以上探究和已掌握的知识,该兴趣小组的同学设计了两个用铜制取硫酸铜的实验方案:
①Cu
CuSO
4; ②Cu
CuO
CuSO
4经过对两种方案的讨论、对比,同学们认为方案②具有的优点有
(填序号),所以工业上制备硫酸铜不是直接利用浓硫酸与铜反应.
A、提高铜的利用率 B、提高硫酸的利用率
C、不产生污染大气的SO
2D、不用浓硫酸,安全性好.

