
题目列表(包括答案和解析)
5.我国展讯公司的“展芯GSM/GPRS手机核心芯片关键技术的研制和开发”研究成果,荣获国家科学技术进步一等奖,这一成果打破了长期以来国产手机产业“有机无芯”的局面。制造芯片常用到高纯硅(Si),工业制取高纯硅的化学方程式是:
SiCl4 + 2H2  Si + 4HCl 。该反应类型属于( )
Si + 4HCl 。该反应类型属于( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
4.各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
A.用汽油除去衣服上的油污 B.用餐具洗洁精清洗餐具上的油污
C.用稀盐酸洗去铁表面的锈 D.用醋洗去水壶的水垢
3.某含铁盐溶液能在高浓度的碱性环境下长期稳定存在,且有较强的灭菌消毒功能,该盐是一种绿色无污染的净水剂,其化学式为Na2FeO3 。则其中铁元素的化合价是( )
A.+2 B.+3 C.+4 D.+6
2.下列实验现象记录正确的是( )
A 纯净的氢气在空气中安静地燃烧,产生淡蓝色的火焰
B 红磷在氧气中燃烧,发出白光,产生大量的白色烟雾
C 碳粉还原氧化铜时,黑色的粉末逐渐变成红色的铜
D 氢氧化镁能使紫色石蕊试液变成蓝色
1.下列叙述中,前者描述化学变化,后者描述物理性质的是( )
A干冰升华 浓盐酸具有挥发性
B 硫酸铜粉末吸水 稀有气体通电时能发出各种颜色的光
C工业制氧气 镁带能在空气中燃烧
D煅烧石灰石 二氧化碳能使澄清石灰水变浑浊
21.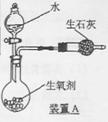
 右图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2 某研究小组取100g生氧剂,放人装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量,他们进行了三次实验。测定结果如下:
右图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2 某研究小组取100g生氧剂,放人装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量,他们进行了三次实验。测定结果如下:
|
测定序号 |
第1次 |
第2次 |
第3次 |
平均值 |
|
反应前装置A总质量(g) |
400.1 |
400.2 |
399.7 |
400.O |
|
反应后装置A总质量(g) |
368.1 |
368.1 |
367.8 |
368.O |
请根据上述实验结果计算:(假设杂质不与水反应产生气体)
(1)100g生氧剂与足量水反应生成的氧气质量;
(2)生氧剂中KO2的质量分数;
(3)若成人每分钟正常需氧量为0.32g,则能维持成人正常呼吸20分钟的“化学氧自救器”,至少要装入这种生氧剂多少克?
20、(9分) 某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
[实验原理]Na2CO3+H2SO4= Na2SO4+CO2↑+H2O
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
[实验装置]
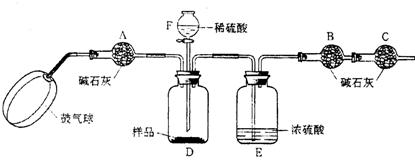
[实验步骤]
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
③按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
据此回答下列问题:
⑴已知碱石灰的主要成分是氧化钙和氢氧化钠,则干燥管A的作用是
,干燥管C的作用是 ,
E装置的作用是 。步骤③中鼓气的目的是 ;
步骤⑥中鼓气的目的是 ;本实验能否同时省略③、⑥两个步骤? ,原因是 。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫
酸(ρ=1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
19.(5分)某溶液甲由三种物质混合而成,且溶液显碱性。取该溶液进行实验:
(1)加入适量可溶性镁盐,产生白色沉淀和一种无色溶液乙。
(2)向溶液乙中加入氯化钡溶液,得到不溶于稀硝酸的白色沉淀和无色溶液丙。
(3)将溶液丙置于蒸发皿中加热,蒸干时只得到固体食盐。则溶液甲是由 、
和 (写化学式)三种物质混合而成,加入的镁盐可能是
或 (写化学式)。
18、(5分)我国著名化学家侯德榜发明的联合制碱法的主要原理是向浓氨水中通入足量的CO2 生成NH4HC03溶液,然后加入食盐细粒充分搅拌,两者发生复分解反应。由于生成的碳酸氢钠的溶解度小,便呈晶体析出;将析出的碳酸氢钠加热得碳酸钠、二氧化碳和水。
(1)写出上述三个反应的化学方程式:
①_________________________________________________ .
②_________________________________________________ ;
③_________________________________________________.
(2)有人认为侯氏制碱法有以下优点 ,你认为其中正确的是____________________
A. 生产过程中部分产物可作为原料使用
B. 副产品是一种氮肥
C. 反应都不需要加热,可节约能源
17、(4 分〉按照一定依据把物质进行分类 , 是认识物质的组成、结构、性质和用途的便捷途径。现有三组物质 : ①金刚石、水银、金属钠、冰②五氧化二磷、干冰、生石灰、 一氧化碳③食醋、白酒、加碘食盐、纯碱。每组中均有一种物质所属类别与其他三种不同 , 这三种物质依次是_______、_________、__________; 它们混合后可以发生反应得到一种重要的化工原料 , 其化学方程式为___________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com