
题目列表(包括答案和解析)
33.6g 14.4g
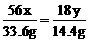 ∴
∴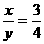
则化学式为Fe3O4
答:该铁的氧化物的化学式为Fe3O4.
例2 把7克含杂质的锌片(杂质不与硫酸反应)放在100克足量的稀硫酸里,反应停止后所得混合物总质量为106.8克.
求:(1)根据 定律,反应后生成H2质量是 克.
(2)计算不纯的锌的质量分数.(计算结果精确到0.1%)
解 (1)根据质量守恒定律,反应前后物质质量总和之差即为放出气体的质量.
∴mH2=7g+100g-106.8g=0.2g
(2)设反应的锌的质量为x
Zn + H2SO4  ZnSO4 + H2↑
ZnSO4 + H2↑
65 2
x 0.2g
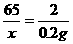 ∴x=6.5g
∴x=6.5g
∴ 锌的质量分数为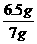 ×100%=92.9%
×100%=92.9%
答:生成氢气0.2克,锌的质量分数92.9%.
例3 0.92g金属Cu与CuO的混合物被H2完全还原后,得到0.752g固体剩余物.求原混合物中含CuO的质量分数?
分析 本题是关于混合物的计算.0.92克物质中含有Cu和CuO,被H2完全还原后,剩下的0.752g固体中只含有Cu,其中的铜一部分是原来的铜,另一部分是还原生成的Cu.本题有四种解法.
解法一 设原混合物中Cu质量为x
H2 + CuO  Cu + H2O
Cu + H2O
80 64
6.2g x y
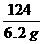 =
=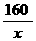 =
=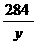 ∴x=8g y=14.2g
∴x=8g y=14.2g
VO2 =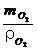 =
=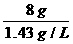 =5.6L
=5.6L
答:需要氧气5.6升.
例5 含锌65%的锌粒200g,与足量的稀H2SO4反应,可制得H2多少升?(标况下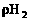 =0.09g/L)
=0.09g/L)
分析 化学方程式中反应物与生成物之间的质量关系指的是纯净物之间的质量关系,不纯物的质量必须转化成纯净物的质量,才能代入化学方程式中进行计算,其换算关系式为:
物质的纯度(%)=  ×100%
×100%
纯净物的质量 = 不纯物的质量×物质的纯度(%)
解 设可制得H2的质量为xg
Zn
+ H2SO4  ZnSO4+ H2↑
ZnSO4+ H2↑
65 2
200g×65% x
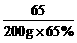 =
=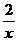
解得x=4g
 H2的体积为
H2的体积为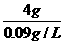 =44.4L
=44.4L
答:可制得44.4升H2.
[难题巧解点拨]
例1 一定质量的KClO3和MnO2的混合物中,MnO2的质量分数为20%,加热后,剩余的固体混合物中MnO2的质量分数升高至25%,则KClO3的分解率是多少?
分析 此题没有给出反应物的质量,但给了反应前后MnO2的质量分数.设MnO2的质量为ag依次算出原混合物质量,KClO3质量,剩余物质量.
解 设MnO2的质量为ag,则原混合物的质量为ag÷20%= 5ag;原KClO3的质量为5ag-ag= 4ag,反应后剩余固体物质的质量为ag÷25%=4ag,根据质量守恒定律,生成mO2=5ag-4ag=ag
设生成agO2,需要KClO3的质量为x
2KClO3 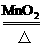 2KCl + 3O2↑
2KCl + 3O2↑
245 96
x ag
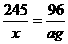 ∴x=
∴x=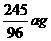
KClO3的分解率= ×100%=63.8%
×100%=63.8%
答:KClO3的分解率为63.8%
例2 将4gH2和O2的混和气体点燃,使其充分反应,得到1.8g水蒸气,则反应前混合物中O2不少于 g,不超过 g.
分析 依题意,有2.2克气体剩余即4g-1.8g=2.2g,设参加反应H2质量为x,O2的质量为y
2H2
+ O2 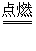 2H2O
2H2O
4 32 36
x=0.2g y=1.6g 1.8g
①若剩余2.2gO2,则参加反应H2不少于0.2g
O2为4g-0.2g=3.8g(即1.6g+2.2g)
②若剩余2.2gH2,则参加反应O2不少于1.6g
H2为4g-1.6g=2.4g(即0.2g+2.2g)
解答 O2不少于1.6g,不超过3.8g.
例3 质量相同的下列金属分别和足量盐酸反应,产生H2最多的是( )
A.Mg B.Al C.Zn D.Fe
分析 本题的常规解题思路为设Mg、Al、Zn、Fe的质量均为ag,然后根据各自的化学方程式分别计算生成的H2的质量,比较大小后得出结论.但此法显然比较繁琐,可用下述方法,找出规律,快速求解,设金属R的相对原子质量为M,与酸反应生成物中化合价为+n价,消耗金属R的质量为mg,则生成H2质量为x
2R + 2nHCl 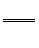 2RCln +nH2↑
2RCln +nH2↑
2M 2n
mg x
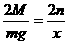 ∴x=
∴x=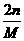 m克
m克
规律:在金属质量相同时产生H2质量与该金属的化合价与相对原子质量之比成正比
本题分别为(A)Mg 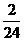 m=
m=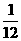 m
m
(B)Al 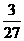 n=
n=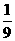 m
m
(C)Fe 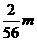 =
=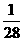 m
m
(D)Zn 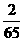 m=
m=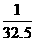 m
m
解答 选(B)
[典型热点考题]
例1 将一定量某种铁的氧化物用足量H2还原后,得到33.6g铁,生成14.4g水,如果氧化物中铁与氧的原子个数比为最简比,试求该铁的氧化物的化学式.
分析 铁的氧化物有多种,设此化学式为FexOy,写出相应化学方程式.
解 设铁的氧化物的化学式为FexOy
FexOy + yH2  xFe + yH2O
xFe + yH2O
56x 18y
12.25g x
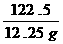 =
= ∴ x=4.8g
∴ x=4.8g
答:加热12.25gKClO3,可制得O24.8g.
例3 把干燥纯净的KClO3和MnO2的混合物13.32克,加热至不再产生气体为止,称量剩余物质量为9.48克,求①生成氧气的质量;②剩余物质各是什么?质量分别是多少克?
分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以13.32g-9.48g=3.84g, 这3.84g就是放出O2的质量,这也是解本题的关键.
解 根据质量守恒定律
mO2 = 13.32g – 9.48g = 3.84g
设生成物中KCl质量为xg
2KClO3 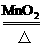 2KCl + 3O2↑
2KCl + 3O2↑
149 96
x 3.84g
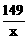 =
=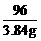 ∴ x=5.96g
∴ x=5.96g
MnO2的质量 9.48g – 5.96g = 3.52g
答:氧气的质量为3.84g,剩余物为KCl和MnO2质量分别为5.96g和3.52g.
例4 在标准状况下,6.2g磷在氧气中充分燃烧,需要氧气多少克?这些氧气的体积是多少升?能生成P2O5多少克?(已知标况下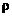 O2=1.43g/L)
O2=1.43g/L)
分析 根据化学方程式的计算要求单位一致,初中阶段只涉及反应物和生成物的质量比计算,所以本题不能直接求出O2的体积,只能先求出生成O2的质量.再根据V气
= 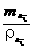 进行换算.
进行换算.
解 设需要氧气的质量为x,生成P2O5的质量为y.
4P + 5O2 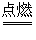 2P2O5
2P2O5
4×31 5×32 2×142
12.25g x
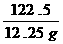 =
=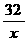 ∴ x=3.2g
∴ x=3.2g
答:加热12.25gKClO3,可制得O23.2g.
(1)错误原因 ;(2)改正 .
分析 根据化学方程式的计算常发生5类错误,本题的错误在于化学方程式没有配平.
解 (1)化学方程式未配平;
(2 )设反应后可制得O2的质量为xg
2KClO3 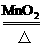 2KCl + 3O2↑
2KCl + 3O2↑
2×122.5 3×32
122.5 32
4.容易发生的错误:(1)题意理解不清、答非所问;(2)化学方程式书写错误,使计算失去正确依据;(3)单位不统一,有时把体积等代入;(4)把不纯物质的量当作纯净物的量代入;(5)计算不认真、粗心大意,如求算式量出现错误等.
例1 10克水通电可制得氢气多少g?氧气多少g?
分析 本题是已知反应物的质量,同时求两种生成物的质量,可根据化学方程式的计算步骤,同时设两个未知量,分别与已知量列比例式求解.
解 设10克水通电可制得氢气的质量为x,氧气的质量为y.
2H2O  2H2↑ + O2↑
2H2↑ + O2↑
36 4 32
10克 x y
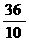 =
=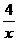 =
=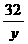
∴ x=1.1g y=8.9g
答:可制得H21.1g, O2为8.9g.
例2 下列根据化学方程式的计算题有错误,简述发生错误的原因,并加以改正.
加热12.25克KClO3,充分反应后可制得氧气多少克?
解 设生成氧气的质量为xg
KClO3 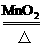 KCl + O2↑
KCl + O2↑
3.关键是明确解题思路:(1)审题 (2)析题 (3)解题 (4)验题
2.含杂质的计算是本节的教学难点
[重点难点解析]
1.书写格式规范是本节的重点
6.答
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com