
题目列表(包括答案和解析)
2.阴离子:得到电子的原子,带负电荷,如O2-、F-、Cl-、S2-、SO2-4等(质子数<电子数)
1.阳离子:失去电子的原子,带正电荷,如Na+、Mg2+、Al3+、NH+4等(质子数>电子数)
3.元素种类的划分
|
元素类别 |
最外层电子数 |
得失电子趋势 |
性质 |
结论 |
|
金属元素 |
<4 |
失去最外层电子 |
较易发生化学反应 |
元素的化学性质与原子的最外层电子数有关 |
|
非金属元素 |
≥4(氢为1) |
易得电子或形成共用电子对以达到8电子稳定结构 |
||
|
稀有气体元素 |
=8(He为2个) |
难得失电子 |
难发生化学反应 |
2.原子结构示意图.
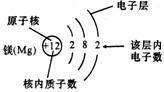
如图,镁原子的结构示意图含义
①+12 表示原子核及核内有12个质子(即原子核带有12个单位正电荷),
②弧线表示电子层
③弧线上的数字表示该电子层上的电子数
1.在含有多个电子的原子里,电子的能量并不相同,故电子是分层排布的.
电子层数 一二三四五六七
离核距离 近→远
电子能量 低→高
填充顺序 先→后
7.(02福州)称取氯化钠和氯化钙的固体混合物14g,放入烧杯中,加入96g碳酸钠溶液恰好完全反应(反应的化学方程式为:Na2CO3 + CaCl2 = CaCO3↓+ 2 NaCl)。待反应完全后过滤,称得滤液的总质量为100g。
(1)根据质量守恒定律,可知生成的沉淀质量为 。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
6.(02甘肃)2001年诺贝尔化学奖授予了美国化学家诺尔斯博士与日本化学家野依良治教授和美国化学家沙普利斯教授,以表彰他们对催化不对称合成的重大贡献。环氧化(R) --丙烯醇(化学式为C3H6O2),是沙普利斯应用不对称合成技术合成的一种重要物质。该物质用于生产一种治疗心脏病 的药物。计算(计算结果保留一位小数):
(1)该物质中碳、氢、氧三种元素的质量比为 ;
(2)该物质中氧元素的质量分数为 。
5.(02扬州)把400g 20%的氯化钠溶液稀释成10%的溶液需加水 ( )
A.100g B.200g C.400g D.800g
4. (02山西)下列四个图象分别表示对应的四种操作过程,其中正确的是 ( )
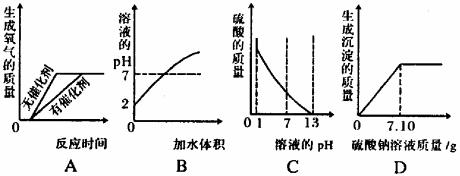
A.加热氯酸钾制取氧气
B.向pH =2的盐酸中不断加水稀释
C.向pH =1的硫酸溶液中逐滴加入pH =13的KOH溶液
D.向10.4g 10%的BaCl2溶液中逐滴加入10%的Na2SO4溶液
3.(02山东)在化学反应A + 2B=C + 3 D中,2g A与4.1g B完全反应,生成5.6 g C。当有1.5g D生成时,参加反应的A的质量是( )
A.6g B.5.6g C.4.5g D.0.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com