
题目列表(包括答案和解析)
1.下列叙述中不符合事实的是―――――――――――――――――――――( )
A. 红磷在氧气里燃烧时产生浓厚的白烟
B. 在熟石灰中加入稀HCl产生大量CO2气泡
C. 向盛有澄清石灰水的试管中通入CO2,石灰水变浑浊
D. 硫在氧气里燃烧,发出明亮的蓝紫色火焰
13.过滤和结晶、蒸馏比较
|
方法 |
原理 |
适用对象 |
基本操作 |
|
过滤 |
根据物质的溶解性不同 |
分离液体中不溶性固体(或两种固体,一种溶,一种不溶) |
溶解、过滤 |
|
结晶 |
根据物质的溶解度随温度变化的不同 |
分离两种可溶性固体 |
加热溶解、冷却结晶 |
|
蒸馏 |
根据液体混合物沸点不同 |
分离液态混合物 |
加热蒸发,冷凝 |
12.过滤操作要点:
①一贴:滤纸紧贴漏斗内壁。紧贴时用水润湿,使漏斗内壁和滤纸间不留气泡。
②二低:滤纸边缘略低于漏斗边缘;漏斗内液面略低于滤纸边缘(以防滤液从滤纸与器壁间渗出)。
③三靠:漏斗最下端紧靠烧杯内壁(防液滴飞溅);玻棒轻靠三层滤纸一边;上烧杯嘴轻靠玻棒(起引流作用)。
11.结晶:从饱和溶液中析出固态溶质的过程叫结晶。具有规则几何外形的固体叫晶体。(1)获得晶体的两种方法
①冷却热饱和溶液--适用于溶液解度受温度变化影响大的固态溶质。
②蒸发溶剂--常用于溶解度受温度变化影响不大的固态溶质。
(2)结晶水:晶体从溶液中析出时结合的一定数目的水分子。
10.溶解度的几个关系式
式中:S-溶解度 m液-饱和溶液质量 m剂-溶剂的质量 m质-溶质质量
①基本公式: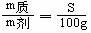 或
或 ,
,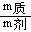 (每克溶剂能溶溶质的最多克数)
(每克溶剂能溶溶质的最多克数)
②演变公式: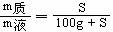

③一定温度下,饱和溶液中溶剂量改变的有关计算

9.溶解度
(1)固体物质的溶解度定义:在“一定温度”下,某物质在“100克溶剂”里“最
多”溶解的“克数”。(四大要素缺一不可)
气体物质的溶解度定义:在“1.01×105Pa”和“一定温度”下,气体在“1体积水”中“达到饱和状态”时所溶解的“体积数”。
(2)影响溶解度的因素:
主要因素:①溶质的本身结构和物理性质
②溶剂的种类
外因:A. 固体溶质:大多数物质温度升高,溶解度增大。(KNO3、NH4Cl…)
少数物质,溶解度受温度变化影响很小。(NaCl)
极少数物质,溶解度随温度升高而减少。(Ca(OH)2)
B. 气体溶质:①温度不变,压强增大,气体溶解度增大;
②压强不变,温度升高,气体溶解度减小。
8.饱和溶液与不饱和溶液的相互转化:
一般规律:
特殊规律:对Ca(OH)2而言,饱和溶液降温会变成不饱和溶液,不饱和溶液升温会变成饱和溶液。
7.正确判断溶质三种情况:
a.与水不反应的物质,溶解的即为溶质(NaCl);
b.与水会反应的物质,溶质指溶解了的反应产物, Na2O + H2O = 2NaOH ;
c.结晶水合物:溶质指无结晶水的部分。如:胆矾(CuSO4·5H2O)溶于水形成的溶液其溶质为CuSO4 。
6.二氧化碳的物理性质:二氧化碳能溶于水,常压下1体积水可溶解1体积二氧化碳,压强愈大二氧化碳在水中的溶解能力愈大。
|
物质 |
氧 气 |
二
氧 化 碳 |
||
|
化
学 性 质 |
氧化性 点燃 C+O2=CO2 点燃 点燃 S+O2=SO2 3Fe+2O2 =Fe3O4 |
不助燃,也不燃烧 CO2+H2O=H2CO3 CO2+Ca(OH)2=CaCO3 ↓+H2O |
||
|
工业制法 |
分离液态空气 (物理变化) |
煅烧 CaCO3=CaO+CO2↑ |
||
|
实验室 制法 |
2H2O2======2H2O+O2↑ △ 2KClO3=2KCl+3O2↑ △ 2KMnO4=K2MnO4+MnO2+O2↑ |
CaCO3+2HCl=CaCl2+H2O+CO2↑ |
||
|
收集方式 |
排水法向上排空法 |
向上排空法 |
||
|
验满 |
把带火星的木条放在集气瓶口,观察是否复燃 |
把燃着的木条放在集气瓶口,不要伸入到集气瓶里。观察是否熄灭 |
5.氧气的物理性质:常温下无色无味气体,密度略大于空气,不易溶于水,低温下为淡蓝色液体或固体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com