
题目列表(包括答案和解析)
7.实验表明,不能用块状大理石与稀硫酸制取CO2气体,而能用大理石粉末与稀硫酸制取CO2气体。由此得出的合理结论是( )
A.能发生反应的物质之间是否发生反应,与反应的条件有关
B.反应物之间接触面积越大,越有利于反应的进行
C.块状大理石与大理石粉末的化学性质不同
D.块状大理石与大理石粉末的内部结构不同
解析:由于大理石粉与硫酸的接触面积大,防止了生成的硫酸钙对该反应的阻碍。块状大理石由于生成的硫酸钙覆盖于表面而使反应停止。
答案:B
6.鱼胆弄破后,会使鱼肉沾上一种叫胆质酸(一种酸)的难溶于水的物质,使鱼肉变苦。要消除这种苦味,用下列何种溶液冲洗最适宜( )
A.食盐水 B.食醋
C.纯碱溶液 D.氢氧化钠溶液
解析:需要找一种显碱性的物质中和胆质酸来消除苦味。纯碱溶液、氢氧化钠溶液显碱性,但氢氧化钠腐蚀性太强,不宜用来洗食物。
答案:C
5.小明在实验时,发现试管里有气泡产生,为了探究该气体是什么,将润湿的红色石蕊试纸放在试管口,观察到试纸变蓝色。则该气体可能是( )
A.CO B.CO2 C.SO2 D.NH3
解析:能使润湿的红色石蕊试纸变蓝色,说明该气体溶于水后呈碱性。初中阶段所学过的气体中,NH3溶于水呈碱性;CO2、SO2、NO2等溶于水呈酸性;CO、H2、O2等不易溶于水。
答案:D
4.保存或使用浓盐酸的合理方法是( )
A.密封保存在阴凉处
B.与氢氧化钠溶液放在同一个药品橱里
C.用烧杯存放浓盐酸
D.把鼻孔凑到容器口闻浓盐酸的气味
解析:浓盐酸具有挥发性,应密封保存且不能与其他类别的物质混放,则选项B、C错误。闻物质气味时,容器口应略低于鼻孔,不能太靠近,则选项D错误。
答案:A
3.在硝酸银和硝酸铜的混合液中,加入适量的铁粉,充分反应后,有金属析出,析出金属的顺序是( )
A.Cu、Fe B.Ag、Fe C.Ag、Cu D.Cu、Ag
解析:根据金属活动顺序表,金属越不活泼,在盐溶液中越先析出。
答案:C
2.食醋是醋酸的稀溶液,某同学准备在家中验证食醋具有酸性质的实验,他选择了下列物质,其中不能发生反应的是( )
A.铁锈 B.铁钉 C.食盐 D.纯碱
解析:酸具有共同的化学性质包括:一是能与酸碱指示剂反应;二是能与活泼金属反应;三是能与金属氧化物反应;四是能与碳酸盐(如纯碱等)反应。醋酸是一种酸,具有酸的性质。
答案:C
1.在发酵面团中加入下列某种物质的溶液揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔。这种物质是( )
A.碳酸钠 B.氢氧化钙 C.氧化钙 D.氯化钠
解析:中和酸需要碱性物质,能够使得馒头疏松多孔需要产生气体。符合上述条件的是碳酸钠。
答案:A
14.用侯氏制碱法制得的纯碱中含有一定量的氯化钠。现称取只含氯化钠的纯碱样品34.6 g放入盛有130 g稀盐酸的烧杯中,恰好完全反应,反应后溶液的质量为151.4 g。请计算:
(1)样品中碳酸钠的质量。
(2)反应后溶液中溶质的质量分数。
解析:解题的关键是能分析出溶液减少的原因是生成的二氧化碳跑掉了,可通过质量守恒定律求出生成的二氧化碳的质量,然后以二氧化碳的质量作为已知条件进行计算。
答案:解:二氧化碳的质量为:130 g+34.6 g-151.4 g=13.2 g。
设样品中碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl====2NaCl+H2O+CO2↑
106 117 44
x y 13.2 g
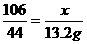 则x=31.8 g
则x=31.8 g
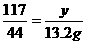 则y=35.1 g
则y=35.1 g
反应后溶液中溶质的质量分数为:
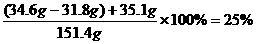 。
。
答案:(1)样品中碳酸钠的质量为31.8 g (2)反应后溶液中溶质的质量分数为25%
快乐时光
究竟谁是议员
富兰克林不仅是著名的科学家,还是一位政治活动家。他曾积极地参加了《独立宣言》的起草,为争取黑人解放发表演说,为建立美国的民主制度进行斗争。他在指责一项有钱人才能有资格当选为议员的法律的时候说:“要想当上议员,就得有30美元。这么说吧,我有一头驴,它值30美元,那么我就可以被选为议员了。一年以后,我的驴死了,我这个议员就不能继续当下去了。请问,究竟谁是议员呢?--是我,还是驴?”
13.(2006北京中考,40) 在研讨酸、碱、盐相互间反应关系时,甲、乙两组同学利用碳酸钠溶液按照以下步骤完成实验(假设每步反应都完全)。
第一步:向碳酸钠溶液中加试剂X,过滤,得白色沉淀;
第二步:向该沉淀中加试剂Y,沉淀全部溶解,生成气体,得无色溶液;
第三步:向该溶液中加试剂Z,过滤,最终得不溶于酸的白色沉淀和硝酸镁溶液。
(1)甲、乙两组同学共进行三次实验,其中所选的试剂均不相同,乙组同学最终得到的不溶于酸的白色沉淀不同于甲组。请将化学式填入下表:
|
|
试剂X |
试剂Y |
试剂Z |
最终得到的白色沉淀 |
|
|
甲组 |
① |
MgCl2 |
|
|
AgCl |
|
乙组 |
② |
|
HNO3 |
|
|
|
③ |
|
|
|
(2)请写出乙组两次实验中碳酸钠溶液与试剂X反应的化学方程式:__________________,_________________________。
解析:由题干信息可知第二步向该沉淀中加试剂Y一定是酸,第三步得到的不溶于酸的白色沉淀是AgCl或?BaSO4,那么甲最终得到的白色沉淀是AgCl,则试剂Y是HCl,因另一种生成物是硝酸镁溶液,所以试剂Z是AgNO3;乙组同学最终得到的不溶于酸的白色沉淀不同于甲组那就是BaSO4,实验②第一步得到的白色沉淀是BaCO3,所以试剂X是BaCl2或Ba(OH)2,试剂Z是MgSO4;实验③是另一种酸则是硫酸,所以试剂X是Mg(NO3)2,试剂Z是Ba(NO3)2。
答案:(1)
|
|
试剂X |
试剂Y |
试剂Z |
最终得到的白色沉淀 |
|
|
甲组 |
① |
|
HCl |
AgNO3 |
|
|
乙组 |
② |
BaCl2(或Ba(OH)2) |
|
MgSO4 |
BaSO4 |
|
③ |
Mg(NO3)2 |
H2SO4 |
Ba(NO3)2 |
(2)BaCl2+Na2CO3====BaCO3↓+2NaCl(或Ba(OH)2+Na2CO3====BaCO3↓+2NaOH)
Mg(NO3)2+Na2CO3====MgCO3↓+2NaNO3
12.在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质为____________。
(2)若反应后,将溶液过滤,所得固体物质加盐酸没有气体产生,则固体物质中一定有____________,可能____________。
(3)若反应后,将析出的金属过滤,向滤液中滴加NaCl溶液,有不溶于稀HNO3的白色沉淀生成,则此时溶液中含有的溶质为________________________。
解析:(1)根据金属活动性顺序:Zn>Cu>Ag,若Zn剩余,则Cu2+、Ag+全部置换出,溶质为Zn(NO3)2。
(2)固体加盐酸,无气体产生,则Zn完全反应,则可能Cu2+未完全置换,所以固体中一定有Ag,可能有Cu。
(3)根据题意,滤液中有AgNO3,则一定有Cu(NO3)2和Zn(NO3)2。
答案:(1)Zn(NO3)2 (2)Ag Cu (3)AgNO3、Cu(NO3)2、Zn(NO3)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com