
题目列表(包括答案和解析)
1.在我国南方一些地区,分布着酸性土壤,不适宜某些作物生长。为改良作物生长条件,当地的农民常用来中和土壤酸性的物质是( )
A.石灰石 B.熟石灰 C.烧碱 D.醋酸
解析:酸性土壤应该使用碱性物质中和。故应该选熟石灰,价格低廉且碱性较弱。烧碱碱性太强容易对植被造成破坏,并且价格太高。
答案:B
26.(2006山东烟台中考,34) (6分)2005年1月1日起,各地环保部门开始对实验室类污染实施严格的环境监管。某校实验室里有含氢氧化钠和碳酸钠的混合废液10.22 kg,该校用某化工厂废弃的溶质质量分数为14.7%的稀硫酸来处理,并回收处理后的溶液。当向混合废液中加入10 kg稀硫酸时,测得溶液的pH=7,此时溶液总质量为20 kg。
(1)原混合废液中碳酸钠的质量是多少?
(2)处理后的溶液的溶质质量分数是多少?
(3)给回收的溶液贴标签时,应如何标明?
解析:设原混合废液中Na2CO3的质量为x,
Na2CO3+H2SO4====Na2SO4+CO2↑+H2O
106 44
x (10 kg+10.22 kg-20 kg)
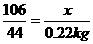
x=0.53 kg
(2)由题意知:处理后的溶液为Na2SO4溶液,
设处理后的溶液中Na2SO4的质量分数为y,
由Na2CO3+H2SO4====Na2SO4+CO2↑+H2O
2NaOH+H2SO4====Na2SO4+2H2O
得出:H2SO4 - Na2SO4
98 142
10 kg×14.7% 20 kg·y
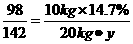
y=10.65%
(3)10.65%的Na2SO4溶液。
答案:(1)原混合废液中Na2CO3的质量是0.53 kg (2)处理后溶液的溶质质量分数是10.65% (3)10.65%的Na2SO4溶液
|
自我盘点 |
|
|
我认为本章的主要内容可分为这几个方面: |
|
|
在学习本章内容时,我所采用的学习方法是: |
|
|
在学习本章内容时,我的心情是这样的: |
|
|
在学习本章的过程中,我最大的感受是: |
|
|
在学习本章后,我记住并能应用的知识是: |
|
|
我将这样来弥补自己在本章学习中所存在的不足: |
|
25.(6分)某固体样品中,可能含有Na2CO3、NaNO3、BaCl2、CuSO4中的一种或几种。将样品溶于水得到蓝色溶液,滴加BaCl2溶液后产生白色沉淀。过滤,向白色沉淀中加入足量的稀硝酸,沉淀不溶解。该固体中肯定存在____________,肯定不存在____________,可能有____________。
解析:能够与BaCl2溶液产生白色沉淀的应该是碳酸盐或硫酸盐,过滤得到的白色沉淀不溶解于稀硝酸,说明该固体为硫酸钡,原溶液含有硫酸铜,一定无碳酸钠和氯化钡,可能含有硝酸钠。
答案:CuSO4 Na2CO3和BaCl2 NaNO3
24.(4分)在置换反应A+B C+D中,
C+D中,
(1)若D为H2,B为稀硫酸,则A的选择应满足什么条件________________________________。
(2)若D为Cu,化合物B的物质类别可能为____________(填“氧化物”“酸”“碱”或“盐”)。
(3)某些非金属也有活动性顺序,已知在溶液中可发生下列反应,Cl2+2NaBr====2NaCl+Br2,Br2+2NaI====2NaBr+I2,则在I2、Cl2、Br2三种非金属中,活动性最强的是____________,活动性最弱的是____________。
解析:根据金属活动顺序表,结合题目信息,活泼金属或非金属能够置换出不活泼的金属或非金属单质。
答案:(1)此物质为位于金属活动顺序表氢元素前面的金属元素
(2)盐 (3)Cl2 I2
23.(6分)如何用纯碱、水、石灰石为原料制取烧碱,写出反应的化学方程式。
①__________________,②____________________,③__________________。
解析:首先烧制石灰,生产氢氧化钙,然后用氢氧化钙制备烧碱。
答案:①CaCO3 CaO+CO2↑ ②CaO+H2O====Ca(OH)2
CaO+CO2↑ ②CaO+H2O====Ca(OH)2
③Ca(OH)2+Na2CO3====2NaOH+CaCO3↓
22.(8分)某海边化工厂利用海水中含有的氯化镁,经过一系列的化学反应,生成纯净的氯化镁,其主要生产过程如下:

石灰石(1)生石灰(2)熟石灰(3)[]利用海水氢氧化镁(4)氯化镁
请写出上述各步转化的化学方程式:
(1)____________________________________。
(2)____________________________________。
(3)____________________________________。
(4)____________________________________。
解析:本题考查物质间的互相关系,对酸、碱、盐、氧化物的通性应熟记。
答案:(1)CaCO3 CaO+CO2↑
CaO+CO2↑
(2)CaO+H2O====Ca(OH)2
(3)Ca(OH)2+MgCl2====Mg(OH)2↓+CaCl2
(4)Mg(OH)2+2HCl====MgCl2+2H2O
21.(3分)酸、碱、盐三类化合物都有各自的组成特点。请在下列各组中找出不属于该类化合物的一种物质,并将其名称写在横线上。
(1)酸:HCl、H2SO4、KNO3____________。
(2)碱:NaCl、KOH、Ca(OH)2____________。
(3)盐:K2SO4、HNO3、(NH4)2SO4、CaCl2____________。
解析:(1)“KNO3”不含氢离子,不属于酸;(2)“NaCl”不含氢氧根离子,不属于碱;(3)“HNO3”?不是由金属离子与酸根离子组成的化合物,不属于盐。
答案:(1)KNO3 (2)NaCl (3)HNO3
20.(2006四川成都中考,19) (7分)有A、B两种固体物质,A是一种化肥,B广泛用作食品干燥剂。把A、B分别放入水中,前者所得溶液温度显著降低,后者与水反应生成C并放出大量热;将A与C的粉末混合、研磨,会嗅到刺鼻的氨味。
(1)则A物质是____________,B物质是____________。
(2)A物质属于化肥中的____________肥(填“氮”“磷”或“钾”)。
(3)指出C物质在农业生产中的一种用途:____________。
(4)把A放入水中所得溶液温度显著降低的原因是________________________。
(5)B与水反应的化学方程式是________________________,反应类型是____________反应。
解析:含氮肥料与碱性物质共热,可以生成氨气,氨气有刺激性气味,因此A是铵盐,B是碱性物质,且B与水反应能够产生大量的热,能作干燥剂,说明B是氧化钙。A溶于水吸热,说明A是硝酸铵。
答案:(1)硝酸铵 氧化钙 (2)氮 (3)制农药等 (4)硝酸铵溶解吸热
(5)CaO+H2O====Ca(OH)2 化合
19.(3分)农作物一般适宜在pH为4~8的中性或接近中性的土壤里生长,为测定某农田土壤的酸碱度,取来适量土样,请完成其pH的测定:
(1)把适量土样放入烧杯,并___________________________________。
(2)蘸取少许土壤浸出液滴在____________上。
(3)将其与_______________________对照,即可测得土壤的酸碱度。
解析:(1)获取土壤浸出液,必须用既不显酸性,也不显碱性的物质去浸泡,如蒸馏水。
(2)可用pH试纸测定溶液的pH。
(3)pH试纸中印有各种颜色的本子称为“标准比色卡”。
答案:(1)加入适量的蒸馏水,用玻璃棒搅拌浸泡 (2)pH试纸 (3)标准比色卡
18.下列各组物质的溶液,不能发生复分解反应的是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4
C.AgNO3和BaCl2 D.KCl和CuSO4
解析:KCl和CuSO4混合,既不能生成沉淀,也不能生成气体和水,因此不能发生复分解反应。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com