
题目列表(包括答案和解析)
6.(2006安徽新课改中考,7) 下列关于化学反应的说法中正确的是( )
A.氧化反应一定属于化合反应
B.生成盐和水的反应一定是中和反应
C.置换反应一定有金属单质生成
D.分解反应一定只有一种反应物
解析:本题考查的是对概念的掌握。氧化反应强调的是有氧气参加,但产物不一定是一种;中和反应强调的是酸和碱反应生成盐和水,但要注意不是说只有酸和碱反应才生成盐和水,如酸性氧化物和碱的反应,碱性氧化物和酸的反应都会生成盐和水;置换反应一定有新的单质生成但不一定就是金属单质;分解反应是一种反应物生成两种或两种以上的生成物的反应。
答案:D
5.不可降解塑料(如一次性快餐盒)带来的“白色污染”日益严重,为了解决这一问题,某市向市民公开征集建议。以下建议不可行的是( )
A.禁止使用塑料制品 B.不滥用塑料制品
C.回收利用废弃塑料 D.开发新型可降解塑料
解析:塑料制品的泛滥导致白色污染的日益严重,因此应该开发使用可降解塑料,或减少塑料制品的使用,并努力进行塑料废品的回收再利用。但不能因噎废食。
答案:A
4.(2006山东滨州中考,7) 下列说法中正确的是( )
A.金属都能和酸发生置换反应生成盐和氢气
B.有盐和水生成的反应一定是中和反应
C.所有物质的溶解度都随着温度的升高而增大
D.原子、分子和离子都是构成物质的粒子
解析:要注意对知识的准确理解和掌握。A项应是排在金属活动顺序表中氢前面的金属能和非氧化性酸发生置换反应生成盐和氢气;B项应是酸和碱反应生成盐和水是中和反应;C项不对,如氢氧化钙溶解度随着温度的升高而降低。
答案:D
3.今年,媒体不断宣传预防肝炎病的传染,从防疫和环保考虑,你认为下列一次性餐具最有发展前景的是( )
A.瓷器餐具 B.淀粉餐具
C.塑料餐具 D.银质餐具
解析:A、D二项成本过高,损耗大,C项会造成白色污染。
答案:B
2.(2006四川成都中考,9) 下列除去杂质的方法中,错误的是( )
|
物质 |
杂质 |
除杂质的方法 |
|
A.CaCl2溶液 |
HCl |
过量CaCO3、过滤 |
|
B.NaOH溶液 |
Ca(OH)2 |
过量Na2CO3溶液、过滤 |
|
C.FeCl2溶液 |
CuCl2 |
过量铁粉、过滤 |
|
D.CH4 |
H2O |
通过盛浓硫酸的洗气瓶 |
解析:除杂的要求是尽量把杂质除去又不引入新的杂质。B项中过量Na2CO3溶液无法除去。
答案:B
1.在社会主义新农村建设中,农民的生活质量和生活条件有明显改善,下列选项中对新农村建设没有促进作用的是( )
A.合理使用农药,减少农药对农产品和环境的污染
B.用清洁能源代替化石能源,减少它们燃烧时对空气的污染
C.农村中有大量天然的井水,不经过消毒杀菌便可直接饮用
D.垃圾进行无害化处理,减少对土壤和地下水的污染
解析:农村中有大量天然的井水,井水中含有较多的细菌、病毒,需要对其杀灭后饮用。否则会严重影响农民的健康。
答案:C
28.(6分)人体内胃酸的主要成分是盐酸,胃酸过多,可引起一系列胃病。最近,美国食品与药品管理局批准胃酸完全抑制剂(Pepcid Commplete)上市,作为治疗胃酸分泌过多的药品,这药品的标签如下图。试通过计算说明,患者按处方服用该药一天,理论上可消耗HCl多少毫克?
|
药品名称 胃酸完全抑制剂(Pepeid Complete) 主要成分 每片内含碳酸钙800 mg和氢氧化镁116 mg 作用用途 用于胃酸过多、烧心型消化不良等 用法、用量 口服 一次1片 每日2次 |
解析:根据反应:
CaCO3 + 2HCl====CaCl2+CO2↑+H2O
100 73
2×800 mg x
x=584 mg
Mg(OH)2+2HCl====MgCl2+2H2O
58 73
2×116 mg y
y=292 mg
所以,每天消耗的盐酸的质量为292 mg+584 mg=876 mg
答案:876 mg
|
自我盘点 |
|
|
我认为本章的主要内容可分为这几个方面: |
|
|
在学习本章内容时,我所采用的学习方法是: |
|
|
在学习本章内容时,我的心情是这样的: |
|
|
在学习本章的过程中,我最大的感受是: |
|
|
在学习本章后,我记住并能应用的知识是: |
|
|
我将这样来弥补自己在本章学习中所存在的不足: |
|
27.(6分)一般情况下,金属越活泼,与酸反应的速度越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验。
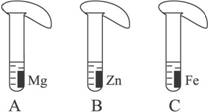
[实验步骤]
①取A、B、C三支试管,分别加入2 mL溶质质量分数相等的稀盐酸;
②分别加入足量的、大小相等的Mg、Zn、Fe三种金属片,立即把三个相同的气球分别套在各试管口上。
[实验预测与分析]
(1)写出铁与稀盐酸反应的化学方程式:________________________________________。
(2)气球膨胀速度最快的是____________(填试管编号)。
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是:_______________。
(4)步骤②是实验成功的关键,你认为在操作过程中小组成员之间应该:_________________。
解析:答题时要结合金属活动性顺序来思考问题。
答案:(1)Fe+2HCl====FeCl2+H2↑ (2)A
(3)锌与酸反应的速率适中,容易控制(或镁与酸反应速率太快,而铁与酸反应速率太慢)
(4)分工合作,团结协作等(其他合理答案均可)
26.(4分)为弄清“显酸性的溶液一定是酸吗”这一疑问,张生同学进行了下列探究活动。
向微型实验仪器(如下图)井穴板的4个井穴中分别滴加稀盐酸、醋酸、硫酸铝、氯化铵四种溶液各3滴,再分别滴一滴紫色石蕊试液。观察到四种溶液均变红色。
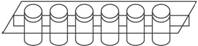
井穴板每一井穴为一个反应容器
(1)本实验说明这四种溶液都显____________性,溶液的pH____________7(填“>”“=”或“<”)。
(2)分析实验过程和现象,你还能得出哪些结论?
①________________________________________________________________________;
②________________________________________________________________________。
解析:能使紫色石蕊试液变红的溶液显酸性,其pH<7,但不一定都是酸。
答案:(1)酸 <
(2)①显酸性的溶液不一定是酸 ②有些盐溶液也显酸性(其他合理答案也可)
25.(2分)有三种物质:①二氧化碳,②生石灰,③食盐。把它们分别放入或通入蒸馏水中,所得溶液的pH由小到大的排列顺序为(用序号填写)________________________。
解析:解题时应知道二氧化碳溶于水生成的碳酸呈酸性,pH<7;生石灰与水接触会发生反应生成氢氧化钙,氢氧化钙溶液就是石灰水,石灰水呈碱性,pH>7;食盐水呈中性,pH=7。
答案:①③②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com