
题目列表(包括答案和解析)
5.自然界的矿物含量非常丰富,我国蕴藏了多种自然界稀少的金属矿物。在下列矿物中,不属于金属矿物的是( )
A.石灰石 B.赤铁矿 C.黄铜矿 D.硫磺
解析:石灰石学名碳酸钙,是金属钙的碳酸盐;赤铁矿是三氧化二铁;黄铜矿是铜的硫化物;硫磺是非金属单质。
答案:D
4.面对纷繁复杂的化学变化,如果我们逐个进行学习和研究,时间上不允许,同时也不便于寻找规律,因此有必要对化学反应进行分类学习。下列反应属于置换反应类型的是( )
A.Zn+H2SO4====ZnSO4+H2↑
B.3Fe+2O2 Fe3O4
Fe3O4
C.CH4+2O2 CO2+2H2O D.2HgO
CO2+2H2O D.2HgO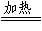 2Hg+O2↑
2Hg+O2↑
解析:置换反应的特征是单质和化合物反应生成新的单质和新的化合物。A项符合。
答案:A
3.铝是生活中最为常见的金属之一。关于铝的“自我保护”能力极强的原因,这一问题引起了同学们的极大兴趣,纷纷提出自己的看法:①铝的化学性质本来不活泼,难被腐蚀;②市场上的铝材料通常是铝合金,合金是不发生化学反应的;③铝性质活泼,表面能产生一层结构致密的氧化膜。你所认同的是( )
A.① B.② C.③ D.①②③
解析:①错误,因为铝的化学性质很活泼;②错误,合金同样能发生化学反应,但合金的机械性能优于纯金属;③正确,由于铝与氧气生成了一层致密的氧化物保护膜,所以铝的性质虽然活泼,但不易于被腐蚀。
答案:C
2.实验和探究是化学学习的重要手段和方法,相信你对身边的许多金属进行过观察和探究,你认为下面说法不正确的一项是( )
A.铜的表面呈现红色,在潮湿的地方放置较长时间会产生铜绿
B.硬币表面是银白色的,它可以导电
C.铅笔芯是用金属铅为主要材料制造的,它是黑色的
D.铁锅通常需要加一个木柄或塑料柄
解析:A项正确,因为在潮湿的环境中金属铜容易生锈,即变成“铜绿”;B项正确,硬币本身是由金属组成,可导电;C项错误,制造铅笔芯的材料是石墨而不是铅;D项正确,因为金属导热效果好,加一个木柄或塑料柄,防止烫手。
答案:C
1.下列化学方程式正确的是( )
A.2Fe+6HCl====2FeCl3+3H2↑ B.CuSO4+2NaOH====Cu(OH)2↓+Na2SO4
C.CaCO3+HCl====CaCl+CO2↑+H2O
D.Mg+O2 MgO
MgO
解析:A项中铁与盐酸反应,生成的是FeCl2而不是FeCl3;C项中CaCO3和稀HCl反应生成CaCl2,而不是CaCl;D项中方程式Mg+O2 MgO没有配平。
MgO没有配平。
答案:B
27.(6分)由下图可知:
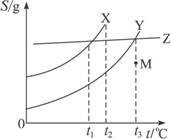
(1)在t2 ℃时,X、Y、Z三物质的溶解度由小到大的顺序是____________。
(2)在____________℃时,X与Z有同一溶解度。
(3)M点在t3 ℃时,对Y物质来说是____________(填“饱和”或“不饱和”)溶液。
解析:溶解度曲线的趋势表示该物质的溶解度随温度的升高的变化趋势。两物质溶解度曲线的交点表示该物质的溶解度在该温度下相等。
答案:(1)Y>Z>X (2)t1 (3)不饱和
26.(6分)现要配制20%的NaOH溶液500克,采用下列各种不同试剂时,应采取(1)纯的固体NaOH____________克;(2)质量分数为96%的工业用NaOH____________克;(3)质量分数为40%的NaOH溶液____________克,配制时的主要步骤为①____________,②____________,③____________。
解析:首先应该计算,然后称量和量取,最后溶解。
答案:(1)100 (2)104.2 (3)250 计算 称量溶质和量取溶剂 溶解
25.(2006四川成都中考,17)(6分)(1)考古发掘出的铜器表面往往有一层厚厚的铜绿(主要成分Cu2(OH)2CO3),试用化学方程式解释铜绿形成的原因。
(2)为什么高档电器的铜质插孔、插头表面要镀上价格比铜昂贵且导电性又不如铜的金?
(3)不法商贩常在金中掺入铜打制“纯金”饰品出售。如何识别这种假冒“纯金”戒指。
|
操作步骤 |
|
|
现象 |
|
|
分析 |
|
(4)许多资源都是不可再生的,每个公民都应树立保护资源的观念。下列做法不利于保护金属资源的是____________(填选项字母)。
A.采取各种有效防锈方法避免金属锈蚀 B.用塑料代替钢和其他合金制造管道
C.私挖、滥采矿物 D.回收利用铝制饮料罐
解析:金属生锈主要由于金属在潮湿的空气中,与水、氧气、二氧化碳等相互作用。如果黄金中掺杂了其他金属如铜,灼烧时变黑,生成氧化铜。“真金不怕火炼”,这是鉴别黄金是否搀假的主要方法。金属矿产资源私挖、滥采,会导致资源的浪费。
答案:(1)2Cu+O2+CO2+H2O====Cu2(OH)2CO3
(2)金的化学性质稳定,不会生锈,利于导电,不会接触不良
(3)空气中加热 戒指变黑 铜变成了氧化铜
(4)C
24.(6分)描述下列实验现象:
①镁带在空气里燃烧--
②铁丝在氧气里燃烧--
③氢气还原氧化铜--
解析:描述实验现象应该根据燃烧的火焰颜色、产物情况等描述。
答案:①镁带在空气中剧烈燃烧,发出耀眼的白光,生成白烟,燃烧后有白色灰烬。
②铁丝在氧气中剧烈燃烧,火花四射,有黑色固体生成。
③黑色粉末逐渐变红,在玻璃管的管壁上有水珠生成。
23.(4分)现有A、B两种金属组成的混合物30克,与足量的稀盐酸反应放出1克氢气。该混合物的组成可能是锌、镁、铁、铝中的(写出所有可能的组成)________________________。
解析:设锌、镁、铁、铝在与酸反应时都看作+2价金属,则各金属的化学式的式量为:锌,65;镁,24;铁,56;铝,18。产生氢气1克,根据反应:
M+2HCl====MCl2+H2↑
x 2
30 g 1 g
x=60
所以,组成该合金的金属的相对原子质量应该满足一个大于60,一个小于60,组合为:镁与锌;锌与铁;锌与铝。
答案:可能的组合为:镁与锌;锌与铁;锌与铝
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com