
题目列表(包括答案和解析)
5.在工农业生产中,许多化学反应都要在溶液中进行的主要原因是( )
A.便于观察现象 B.溶液间的反应不需加热
C.水是反应的催化剂 D.溶液中分子或离子接触充分,反应速率快
解析:只有在溶液中分子或离子才能充分接触,发生反应的机会较多,反应速率才能加快。
答案:D
4.乳化在工农业生产和日常生活中有十分广泛的应用。下列应用与乳化现象无关的是( )
A.金属表面油污的清洗 B.高锰酸钾溶于水进行杀菌消毒
C.有机农药的合成或使用 D.各种日用洗涤剂和化妆品的配制
解析:乳化作用是指能够把油或难溶于水的有机物以小液滴的形式分散在水中,形成乳浊液。高锰酸钾溶解于水形成溶液,与乳化无关。
答案:B
3.下列物质属于溶液的是( )
A.石灰浆 B.生理盐水 C.菜汁 D.牛奶
解析:根据溶液、浊液的区别,可知生理盐水是氯化钠以离子形式分散在水中,形成的均一、稳定的混合物,属于溶液。
答案:B
2.花生油、盐、酱、醋是厨房中常用的调味品,将它们分别与足量水充分混合后,形成的混合物属于溶液的是( )
①花生油 ②食盐 ③面酱 ④白醋
A.①③ B.②③ C.①④ D.②④
解析:能形成均一、稳定的混合物才是溶液,花生油、面酱不能形成均一、稳定的混合物,而食盐、白醋则能。
答案:D
1.取A g食盐固体溶于水,得到食盐溶液200 mL。从食盐溶液中取出10 mL,则对于这部分溶液的描述不正确的是( )
A.该溶液中含有的食盐的质量为Ag/20 B.该溶液的密度比原溶液的大
C.该溶液的密度与原溶液相同 D.该溶液与原溶液一样咸
解析:食盐溶液是均一、稳定的混合物,取出的10毫升溶液中含有原溶液溶质的1/20,取出的溶液与原溶液完全相同。故B项不正确。
答案:B
13.(2006江苏徐州中考,22) 溶液在生产和科研中具有广泛的用途。在农业上,为了选种子,需要配制15%的盐溶液。现有30 kg食盐固体,可配制食盐溶液____________kg。配制食盐溶液的一般步骤为①________________________,②________________________,③溶解。
解析:根据质量分数公式计算出溶液的质量=30 kg÷15%=200 kg。配制溶液的步骤一般为:①计算;②称量固体和量取液体;③溶解。
答案:200 计算 称量固体和量取液体
快乐时光
各有解释
一学生提出“打人与被打有何不同”,请教老师。历史老师:打人是侵略者,被打是受害者。英文老师:打人是主动式,被打是被动式。物理老师:打人是施力,被打是受力。教导主任:各记大过一次。
12.A、B两种固体物质的溶解度曲线如图所示。请完成下列问题:
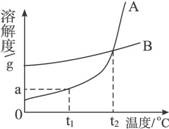
(1)t1 ℃时,A物质的溶解度为____________ g。
(2)t2 ℃时,A、B两种物质的溶解度____________(填“相同”或“不同”)。
(3)我国有些地区有一种说法:“冬天捞碱,夏天晒盐。”这里的碱是指Na2CO3,盐是指NaCl。那么,图中____________(填“A”或“B”)的溶解度曲线与Na2CO3的溶解度曲线相似。
(4)人们用上述方法从盐湖中捞得的NaCO3会含有少量的NaCl。某研究性学习小组称取含NaCl的Na2CO3固体12.5 g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到4.4 g CO2气体,则原固体中Na2CO3的质量分数为____________%。
解析:(1)从曲线上可以查出;(2)两条曲线的交点是指在对应的温度下A、B两种物质的溶解度相等;(3)Na2CO3的溶解度受温度影响较大,而NaCl较小;(4)由化学方程式计算出Na2CO3的质量,再计算Na2CO3的质量分数。
答案:(1)a (2)相同 (3)A (4)84.8
11.海洋是巨大的资源宝库,从海洋中可提取许多重要物质。请你参与下列探究活动并完成有关问题:
(1)我市某盐场测得:①海水含NaCl约为3.5%;(即指溶质氯化钠的质量占整个溶液中质量的百分比为3.5%,下同)②在海边打深井;③井水中含NaCl约为8%。晒盐最好选择____________(填序号)作原料,理由是________________________。
(2)关于晒盐原理的说法正确的是____________。
A.利用阳光和风力,使氯化钠蒸发出来
B.利用阳光和风力,使水分蒸发,析出食盐
C.降低温度使氯化钠析出
D.日光照晒后,氯化钠的溶解度变小
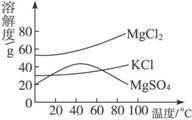
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质。参照图中各物质的溶解度曲线,从卤水中提取氯化钾晶体可采用下列方法:
①将卤水加热到60 ℃以上蒸发水分后,会逐渐析出____________(填名称)晶体,其理由是________________________。
②将①中的晶体过滤后,得到滤液,把滤液降温至30℃以下,又析出氯化钾晶体,然后用少量的____________(填“热水”或“冷水”)洗涤这两种晶体的混合物,就可以得到较纯的氯化钾晶体。
解析:氯化钠的溶解度受温度影响变化不大,应采用蒸发水分离出晶体。根据曲线图对比几种物质溶解度曲线的不同点后再进行判断。
答案:(1)② NaCl的质量分数大,经土层过滤后污染小 (2)B
(3)①硫酸镁 温度高于60 ℃后硫酸镁的溶解度随温度升高而减小 ②冷水
10.禽流感期间,某养殖户需配制2 000 g 2%(即指溶质氢氧化钠的质量占整个溶液中质量的百分比为2%)氢氧化钠溶液以给禽舍用具进行杀菌消毒。试计算完成:
(1)配制时需称取氢氧化钠固体____________ g,水____________mL(水的密度取1 g·cm-3)。
(2)用质量为23.1 g的烧杯为容器,在托盘天平上称取所需的氢氧化钠固体时,请在下表中选出所需的砝码(打“√”表示选用),并在图中选出能正确表示游码位置的选项(填序号)____________。
|
法码大小/g |
100 |
50 |
20 |
20 |
10 |
5 |
|
打“√”表示选用 |
|
|
|
|
|
|

解析:(1)根据公式“溶质质量=溶液质量×质量分数”和“溶剂质量=溶液质量-溶质质量”进行计算;(2)根据托盘天平使用的注意事项?思考。
答案:(1)40 1 960 (2)C
|
法码大小/g |
100 |
50 |
20 |
20 |
10 |
5 |
|
打“√”表示选用 |
|
√ |
|
|
√ |
|
9.如图所示,在常温下将一个塑料小球放入盛有饱和食盐水的烧杯中,塑料小球漂浮在食盐水中。

(1)现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,小球在液面沉浮有何变化?____________,并简述理由:________________________。
(2)若要在不用外力的情况下使小球略上浮,你准备采取的具体方法是___________________。
解析:饱和食盐水中再加入氯化钠晶体后,晶体不溶解,所以烧杯内溶液的密度不变,小球在液面上的沉浮情况不变。要想使小球上浮,就要设法使其溶液的密度增大。
答案:(1)沉浮情况不变 因为氯化钠晶体加入到氯化钠饱和溶液中,在温度不变的情况下,不会继续溶解,溶液的密度不变,小球排开液体的体积也不变
(2)升高温度后加入氯化钠晶体,使溶液的密度增大(或加入其他可溶性固体物质,如硝酸钾,使溶液的密度增大等)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com