
题目列表(包括答案和解析)
3.某溶液中的Cl-和I-的物质的量浓度相等,为了氧化I-而不使Cl- 被氧化,根据下列反应可选用的氧化剂是
2MnO4- + 10Cl -+16H+ = 2Mn2+ + 5Cl 2 ↑+ 8H2O
2Fe3+ + 2I- = 2Fe2+ + I2
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
A、FeCl2 B、氯气 C、KMnO4 D、FeCl3
2.LiH是一种氢气发生剂,用于军事或其他需氢气的场合。反应为:LiH+H2O=LiOH+H2↑在这个反应中 ( )
A.水是氧化剂,LiH是还原性 B.LiH是氧化剂,水是还原剂
C.LiH既是氧化剂又是还原剂 D.该反应转移的电子数为2
1.下列叙述正确的是
A、还原含某元素的化合物一定得到该元素的单质
B、失电子越多,该物质的还原性就越强
C、阳离子也可能失去电子被氧化,可能做还原剂
D、含有最高价元素的化合物一定具有强氧化性
9.有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种。
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式: ;
(2)试写出工业上用电解方法冶炼D单质的化学方程式 ;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目: ;
(4)写出实验室制取单质E的化学方程式: 。
8.右图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
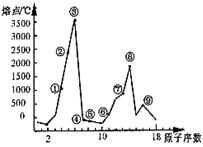 (1) ③号元素位于周期表第____周期第_____族,其单质的一种同素异形体能导电,该同素异形体的名称叫________
(1) ③号元素位于周期表第____周期第_____族,其单质的一种同素异形体能导电,该同素异形体的名称叫________
⑵ ④号元素形成的气态氢化物的电子式为__________,属于_____分子(填极性或非极性)
⑶ ⑥、⑦两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________
⑷ ⑨号元素的原子结构示意图为_______________________。
⑨与⑤两种元素形成的一种化合物是污染大气的主要有害物质之一,
它对环境的危害主要是:_____________________________________________
7.(15分)置换反应的通式可以表示为: 单质⑴+化合物⑴===化合物⑵+单质⑵
请写出满足以下要求的3个置换反应的化学方程式:
①所涉及的元素的原子序数都小于20;②6种单质分属于6个不同的主族。
6. 右表是元素周期表的一部分。已知A元素的原子中p电子
|
|
|
A |
|
|
|
|
|
|
比s电子多一个,且与A直接相邻的元素都是短周期元素。
(1) 在表中填写其他元素的名称,
它们形成的简单离子中半径最大的是___________(写符号)
(2) A与表列同周期元素之间形成化合物的分子式为____________,表列某元素的最高价氧化物对应的水化物与气态氢化物之间的化学方程式为_____________________________
(3)表列元素与氢气反应的生成物中沸点最高的是__________(写化学式),该物质的晶体中不存在
(A)分子间的作用力 (B) 氢键 (C) 共价健 (D)离子键
5.下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
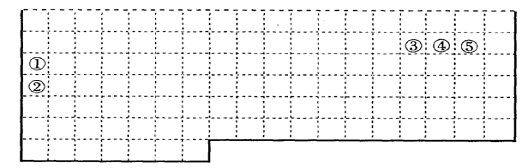
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤和④的离子半径大小关系是⑤___________④(填“大于”或“小于”)。
元素③氢化物的电子式为_______。
(3)元素④-般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是___。
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
4.
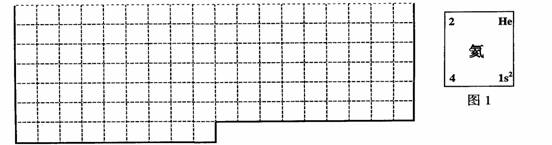 (1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和原子结构示意图。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和原子结构示意图。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:
甲、乙的最高价氧化物水化物的酸性强弱为: (用化学式表示)
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的 ,请写出元素在元素周期表中的位置与元素原子结构的关系:
3.现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
|
X |
K电子数比L层电子数少4个 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
L层有三个未成对电子 |
(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物对应水化物的电离方程式________________________
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com