
题目列表(包括答案和解析)
8.测知由Fe2(SO4)3和FeSO4组成的混合物中含硫a%,则其含铁量应为
A.(100-4a)% B.(100-2a)% C.(100-a)% D.(100-3a)%
7.下列物质发生反应时其离子方程式不正确的是
A.铁与三氯化铁溶液反应:Fe+2Fe3+=3Fe2+
B.足量的氯气通入溴化亚铁溶液中:2Fe2++4Br-+3Cl2 =2Fe3++2Br2+6Cl-
C.Fe(OH)3跟盐酸反应:Fe(OH)3+3H+ = Fe3++3H2O
D.FeS跟稀硝酸反应:FeS+2H+=Fe2++H2S↑
6.(2000广东)把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
A. 是Fe3+和Cu2+ B. 是Fe2+和Cu2+ C. 是Fe2+和Fe3+ D. 只有Fe2+
5.(1997上海)在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol / L的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe3+ 离子。则下列判断正确的是
A. 混合物里三种物质反应时消耗盐酸的物质的量之比为1∶1∶3
B. 反应后所得溶液中的Fe2+ 离子与Cl- 离子的物质的量之比为1∶2
C. 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D. 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
4.(1993全国)将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A. 2∶3 B. 3∶2 C. 1∶2 D. 1∶1
3.下列离子组能在溶液中大量共存的是
A、Mg2+、Fe3+、SO42–、I– B、Fe2+、H+、Cl–、NO3–
C、Na+、Fe3+ 、HCO3–、Cl– D、Mg2+、Fe3+、SO42–、Cl–
2.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是 A.10mol·L-1HCl溶液 B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液
1.把金属铁加入含FeCl3、FeCl2、CuCl2的混合液中充分反应后,
(1)铁全部溶解,且没有固体,则滤液中肯定有阳离子 ,肯定不存在阳离子 ,可能有阳离子
(2)过滤,滤出不溶物有铜,则滤液中肯定有阳离子 ,肯定不存在阳离子 ,可能有阳离子
(3)过滤,滤出不溶物有铁,则滤液中肯定有阳离子 ,肯定不存在阳离子 ,可能有阳离子
4.归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可整理出如下表所示部分数据和性质。请根据下表回答问题:
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
原子半径(nm) |
0.066 |
0.104 |
0.117 |
0.137 |
|
主要化合价 |
-2 |
-2,+4,+6 |
|
-2、+4、+6 |
|
常况下单质色态 |
无色气体 |
淡黄色固体 |
灰色固体 略带金属光泽的 |
|
|
主要单质熔点(℃) |
-218.4 |
113 |
217 |
450 |
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
(1)碲的常况下单质的色态为 ;硒最稳定化合价可能是__________。
(2)氧只能与周期表中某一种元素反应生成+2价化合物,该化合物的化学式为 ;氧族元素中含有18e-的两种氢化物的化学式为 。
(3)氢硒酸敞放在空气中易变质,其可能发生的化学方程式为___ ___ ___。
 (4)工业上用Al2Te3来制备H2Te,请完成化学方程式:__A12Te3+___( )==___A1(OH)3↓+___H2Te↑
(4)工业上用Al2Te3来制备H2Te,请完成化学方程式:__A12Te3+___( )==___A1(OH)3↓+___H2Te↑
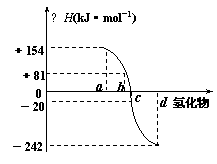
(5)已知:在298K、1.01×105Pa(标准热力学状态)下,
由稳定的单质发生反应生成1mol化合物的反应热叫该化合
物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的
生成热数据示意图。试回答下列问题:
①请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
②写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式为 。
(6)工业上常用价格便宜的Na2S代替NaOH作为碱来使用,结合离子方程式解释其原因: 。
二卷强化训练(化学反应与能量)
3. 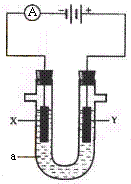 (15分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(15分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验
开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com