
题目列表(包括答案和解析)
4.同一主族的两种元素的原子序数之差不可能是
A.16 B.26 C.36 D.46
(4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及应用。
3.下列叙述错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
(3)了解原子核外电子排布。
2.13C-NMR(核磁共振)、15N-NMR可测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
(1)了解元素、核素和同位素的含义
1.铋(Bi)在医药方面有重要应用。下列关于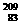 Bi和
Bi和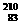 Bi的说法正确的是
Bi的说法正确的是
A 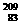 Bi和
Bi和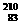 Bi都含有83个中子 B
Bi都含有83个中子 B 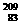 Bi和
Bi和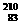 Bi互为同位素
Bi互为同位素
C 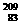 Bi和
Bi和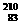 Bi的核外电子数不同 D
Bi的核外电子数不同 D 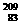 Bi和
Bi和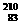 Bi分别含有126和127个质子
Bi分别含有126和127个质子
(2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
10.已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性, 0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性, 请回答下列问题:
(1) 高碘酸是_____(填写“强酸”或“弱酸”),原因是__________________________
______________________________________________________________________。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸, 此反应的氧化剂是________,反应的离子方程式为___________________________________________
________________________________________________________________________。
答案(1)弱酸(2分),由于高碘酸溶液的c(H+)与NaOH溶液的c(OH-)相等,二者等体积混合后,混合液显酸性,说明酸过量,原高碘酸溶液中只有一部分高碘酸的分子发生了电离,所以高碘酸是弱酸。(2分)(2)高碘酸(2分)
5H3IO5+2Mn2+=2MnO4-+5IO3-+2H2O+11H+ (2分)
9.Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因,并写出有关的化学方程式。
(因为Na2S水解生成的H2S有毒,可杀虫; 水解是吸热反应,热水溶解Na2S时促使平衡右移动,增大H2S的浓度。有关化学方程式为Na2S +H2O 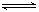 NaHS+
NaOH,NaHS +H2O
NaHS+
NaOH,NaHS +H2O
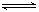 NaOH +H2S )
NaOH +H2S )
8.水玻璃在工业上可作粘合剂,当它与NH4Cl溶液接触时,会很快凝结。原因是
(NH4Cl溶液因NH4+ 发生水解而呈酸性,水玻璃与其接触时,SiO2与H+结合生成硅酸胶体而凝结。)
7.下列各组物质能一起混合施用的是 ( B )
A. 铵态氮肥和草木灰(含K2CO3)混合施用
B. 化肥和农家肥(如绿肥)混合施用
C. 重钙施入碱性土壤中
D. 复合肥(如磷酸氢二铵)和生石灰一起施用
6.用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时 (D )
A. 醋酸和氢氧化钠物质的量相等 B. 醋酸和氢氧化钠恰好中和
C. 氢氧化钠过量 D. 醋酸有剩余
5.某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是 (AD )
A. c( )>c(Cl-)>c(OH-)>c(H+) B. c(
)>c(Cl-)>c(OH-)>c(H+) B. c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
C. c(Cl-)>c( )>c(H+)>c(OH-) D. c(
)>c(H+)>c(OH-) D. c( )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com