
题目列表(包括答案和解析)
24.有关键能数据如表:
则晶体硅在氧气中燃烧的热化学方程式:
Si(s)+O2(g)==SiO2(s)中,△H= -989.2 kJ·mol-1,
则X的值为:
A. 460 B. 920 C. 1165.2 D. 423.3
(3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
23.下列关于反应能量的说法正确的是
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ΔH=-216 kJ·mol-1;反应物总能量>生成物总能量
B.CaCO3 ( s) =CaO(s) +CO2 (g) △H=+178. 5 kJ·mol-1 ;反应物总能量>生成物总能量
C.l0lkPa 时,2H2 (g)+ O2 (g)=2H2O(1) ΔH=-571. 6 kJ·mol-1;H2的燃烧热为571.6 kJ·mol-1
D.H+ (aq) +OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 ;含 1molNaOH 的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
22.已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1
C(金刚石)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1据此判断,下列说法正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
21.R2O8n-在一定条件下可以把Mn2+氧化为MnO4-,本身转化为RO42-。又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n的值是 ( )
A.1 B.2 C.3 D.4
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
20.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I- = 2Fe2+ + I2
19. Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂 B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物 D.2mol FeSO4发生反应时,反应中共有8mol电子转移
(1) 了解氧化还应反应的本质是电子转移。了解常见的氧化还原反应。
18.下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.O3+2KI+H2O==2KOH+I2+O2 B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2 D.4HCl+MnO2==MnCl2+Cl2↑+2H2O
17.下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
16.判断下列有关化学基本概念的依据正确的是
A 氧化还原反应:元素化合价是否变化
B 共价化合物:是否含有共价键
C 强弱电解质:溶液的导电能力大小
D 金属晶体:晶体是否能够导电化学反应与能量
15.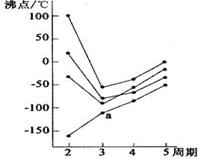 下图中每条折线表示周期表ⅥA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
下图中每条折线表示周期表ⅥA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl C.PH3 D.SiH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com