
题目列表(包括答案和解析)
11.下列离子方程式书写正确的是
A.Mg(HCO3)2溶液与过量NaOH: Mg2++2HCO3-+2OH-=MgCO3↓+2H2O
B.碳酸钙加入醋酸: CO32- + 2CH3COOH = CO2↑+ 2CH3COO- + H2O
C.硫化亚铁跟盐酸反应: S2- + 2H+ = H2S↑
D.NaHSO4中加入Ba(OH)2至溶液呈中性:
Ba2++2OH--+SO42- + 2H+=BaSO4↓+2H2O
10.下列离子方程式书写正确的是
A.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
B.硫酸铜溶液跟氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
C.碳酸钠溶液中加入少量稀盐酸: CO32- + H+ = HCO3-
D.铜与稀盐酸反应: Cu + 2H+ = Cu2+ +H2↑
9.下列离子方程式书写正确的是
A.铜片与稀硝酸反应 Cu + NO3-+ 4H+ = Cu2+ + NO↑+ 2H2O
B.次氯酸钙与亚硫酸: Ca2++2ClO-+ H2SO3=CaSO3↓+2HClO
C.把一小块锌投入过量FeCl3溶液中: 2Fe3+ + Zn = Fe + 3Zn2+
D.在漂白粉的溶液中加入过量的CO2:ClO-+ CO2 + H2O = HCO3-+ HClO
8.下列各组离子能在pH=14的溶液中大量共存的是
A.Al3+、Na+、HCO3- 、SO42- B.K+、SO32-、I- 、H+
C.Na+、AlO2- 、NO3- 、K+ D.NH4+、Al3+、Cl- 、SO42-
7.下列各组离子能在pH=1的无色溶液中大量共存的是
(A)Ba2+、Na+、I- 、ClO- (B)Mg2+、Cl- 、Al3+、SO42-
(C)K+、Cl-、HCO3-、NO3- (D)Ca2+、Na+、Fe3+、AlO2-
6.下列各组离子中,可能能大量共存的是:
A.K+、H+、S2O32-、Cl- B.H+、MnO4- 、I- 、K+
C.H+、Na+、SiO32- 、NO3- D.NH4+、Al3+、H+ 、SO42-
5.下列各组离子中,可能能大量共存的是:
A.加入铝粉有氢气产生的溶液中:Na+、CO3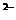 、C1-、K+
、C1-、K+
B.pH = 14的无色溶液中:Na+、K+、HCO3-、NO3-
C.在0.1mol/L的盐酸溶液中:Fe2+、Na+、ClO-、Ca2+
D.在c(H+)/c(OH-)= 1×10-12 的溶液中:NH4+、Ca2+、C1-、K+
4.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法错误的是
A.锂离子电池放电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池充电时电池内部Li+向负极移动
D.锂离子电池充电时阳极反应为C6Li1-x+xLi++x e-===C6Li
3.金属镍有广泛的用途。粗镍中只含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu) ﹙ ﹚
A.阳极被氧化,电极反应式只有:Ni - 2e- == Ni2+
B.电解过程中,阳极质量的减少比阴极质量的增加小
C.电解后,溶液中存在的金属阳离子有Cu2+、Ni2+、Fe2+ 和Zn2+
D.阴极发生的反应只有:Ni2+ + 2e- == Ni
2.将0.1 L含有0.01mol CuSO4和0.02molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com