
题目列表(包括答案和解析)
22.(2分) 认真分析下列各组物质,每组中都有一种物质与其他物质所属类别不同,请在下面横线上填写这种物质的化学式:
(1)水、氧化铜、 水银、三氧化硫 ;
(2)硫酸铜、硝酸、氯化锌、硝酸银 。
21.(3分)实验室现有下列药品:盐酸(5%)、硫酸(5%);大小相同的镁片、铝片、铁片;铁粉、铝粉。某同学为了比较金属与酸的反应,按下图所示的实验方案进行实验。
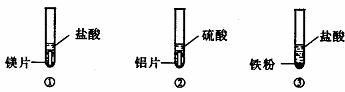
从实验开始到反应5分钟,所观察到的现象记录如下:
|
编号 |
① |
② |
③ |
|
现象 |
金属表面立即有大量无色气泡冒出,反应不到5分钟金属已消失 |
金属表面慢慢有少量无色气泡冒出。反应到5分钟时,铝片还在冒气泡 |
铁粉中不断有无色气泡冒出。气泡的量比②中多,溶液逐渐显浅绿色,反应到5分钟时,铁粉还在冒气泡 |
该同学根据上述实验现象得出结论:金属与酸反应的剧烈程度按镁、铁、铝的顺序减弱。
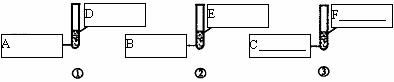
你认为该同学的结论是否合理(填“合理”或“不合理)_______________,如果有不合理的地方,请你在上述设计的基础上完善该实验,在下图6个方框中填写所需的化学药品;如果合理,可以不填。
20.(3分)某学生在一定温度下,向质量均为100g的四份水中分别加入一定质量的KNO3固体,搅拌至充分溶解(如有不能溶解的KNO3,则过滤除去),得到溶液。该学生在实验中记录的数据如下:
|
实验序号 |
实验1 |
实验2 |
实验3 |
实验4 |
|
水的质量(g) |
100 |
100 |
100 |
100 |
|
加入KNO3的质量(g) |
80 |
100 |
120 |
140 |
|
溶液质量(g) |
180 |
200 |
210 |
210 |
根据上述数据分析,实验4得到的溶液属于_________溶液(填“饱和”或“不饱和”)。该温度下KNO3的溶解度是____________g。
19.(2分)
实验室制取氯气的反应原理为:MnO2+4HCl(浓) X+2H2O+Cl2↑,其中X的化学式为_________,实验室收集的氯气中常常混有较多的__________气体。
X+2H2O+Cl2↑,其中X的化学式为_________,实验室收集的氯气中常常混有较多的__________气体。
18.(4分)(1)从下列仪器中选择适当的序号填空:
①量筒 ②烧杯 ③玻璃棒 ④试管 ⑤蒸发皿
其中常用作少量药品反应的容器是_________,加热时必须垫上石棉网的仪器是 ,用于量取一定体积液体的仪器是______________。
(2)为完成过滤操作,除选用(1)中的部分仪器外,还缺少的玻璃仪器是 。
17.(4分)A、B、C、D为四种化合物,在日常生活中都有广泛的应用。通常状况下,A、B为液态,C、D为固态。A是生命之源和宝贵的自然资源;B是一种重要的有机物,又是实验室常用的燃料;C是为人体生命活动提供能量的主要物质,有甜味;D是一种由两种元素组成的固体干燥剂,遇A后放热,使A成为蒸气。请回答:
(1)B的俗名是 ; C的名称是 ;
(2)写出D遇A后发生反应的化学方程式: ;该反应属于 反应(填基本反应类型)。
16.(6分)请将正确的化学符号填在下列相应的横线上。
①铁元素 ; ②2个氧分子 ;
③硫酸根离子 ; ④硝酸镁 ;
⑤常温下呈液态并呈碱性的氮肥 ;
⑥人体内含量最多的元素与地壳中含量最多的金属元素所形成的化合物的化学式为 。
15.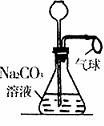 如右图所示,通过长颈漏斗向该装置中慢慢加入x,可观察到气球逐渐胀大,再慢慢加入y,又看到气球逐渐变小,则x、y分别为
如右图所示,通过长颈漏斗向该装置中慢慢加入x,可观察到气球逐渐胀大,再慢慢加入y,又看到气球逐渐变小,则x、y分别为
A.盐酸、硫酸铜溶液 B.盐酸、氯化钙溶液
C.硫酸、氢氧化钠溶液 D.硫酸、氯化镁溶液
第Ⅱ卷 (非选择题,共70分)
可能用到的相对原子质量:H-1 Na-23 C-12 O-16 S-32 F-19
14.氯化钙溶液中含有少量盐酸,欲将盐酸除去,得到较纯的氯化钙溶液,则应向溶液中加入的物质是
A.纯碱 B.氢氧化钠溶液 C.硝酸钾溶液 D.石灰石
13.已知钠、钾等金属在常温下可与水发生剧烈反应,如金属钠与水反应的化学方程式为:
2Na+2H2O===2NaOH+H2↑,据此判断下列说法中错误的是
A.钠不能保存在水中
B.将石蕊试液滴入钠与水反应后的溶液中会变为蓝色
C.不能用手直接拿金属钠
D.在此反应中,钠与参加反应的水的质量比为1∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com