
题目列表(包括答案和解析)
2.镁在氧气中燃烧生成氧化镁,在这个反应中,镁、氧气、氧化镁的质量比是
(A)24:32:56 (B)24:32:40 (C)2:1:2 (D)48:32:80
1.钠原子与钠离子之所以同属于钠元素的原因是( )
(A)具有相同的电子层数 (B)具有相同的质子数
(C)具有相同的中子数 (D)具有相同的相对原子质量
10.根据下面给出的药品和实验装置,设计一个实验,粗略测定由铜和锌两种金属组成的合金-黄铜中锌的质量分数(黄铜已加工成粉末)。
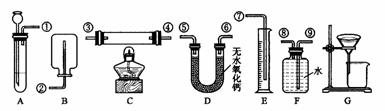
药品:稀硫酸、浓硫酸、氧化铜实验装置:另有托盘天平可用,根据你设计的实验方案回答下列问题:⑴你选用的药品是______________________________________。
⑵你选用的实验装置有(填装置编号)________________________。若需要组装,则连接的顺序是(用装置接口出的编号表示)__________________________( 若不需要组装,则不填)。
⑶称取ag黄铜粉样品进行实验,实验中你测定的其他有效数据是( )
A.生成H2的体积bL B.反应前仪器和药品的质量cg
C.反应后剩余固体的质量dg D.反应后仪器和药品的质量eg
⑷计算合金中锌的质量分数。(可能用到的数据:相对原子质量: Zn-65 Cu-64
O-16 H-1; 在实验条件下,2.0g H2的体积为22.4L)
9. CO和O2在有催化剂和加热条件下,很容易发生下列反应:2CO + O2 2CO2
CO和O2在有催化剂和加热条件下,很容易发生下列反应:2CO + O2 2CO2
又已知标准状况下22.4mLCO2与足量的饱和石灰水作用可生成CaCO3100mg。
现针筒内贮有200mLCO2、CO、O2的混合气体(标准状况下),假设其中CO2为xmL,CO为ymL,其余为O2(足量)。某校初三化学实验小组利用以下实验仪器,组装成一套实验装置,用来测定混合气体中各气体的体积:
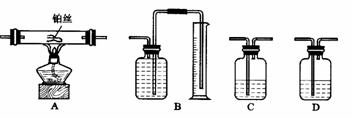
请回答下列问题:⑴从针筒压出的气体,从左到右流过的装置连接顺序应该是( 用A、B、C、D…表示)__________。
⑵吸收瓶C 和D中所盛的吸收溶液是足量的____________,装置B中所盛的可以是________。
⑶实验完毕,在装置B的量筒中液体的体积约为_________mL。(用含x、y的式子表示)。
⑷在⑴装置中,从左数第一个吸收瓶中产生的CaCO3的质量约为_________mg,第二个吸收瓶产生的沉淀质量约为______mg。(用含x、y的式子表示)。
⑸如果第一个吸收瓶[在⑴装置]中得到200mgCaCO3沉淀,第二个吸收瓶得到150毫克沉淀,则原混合气体中含CO2的体积为________mL,含O2的体积为______mL。
8、⑴浓H2SO4与木炭共热,生成CO2、SO2和H2O,写出反应的化学方程式。
⑵已知SO2能使品红溶液褪色,也能使澄清石灰水变浑浊;而CO2不能使品红溶液褪色;SO2能被酸性KMnO4溶液吸收而除去。而CO2不能被酸性KMnO4溶液吸收。试用下图所列各种装置,设计一套实验来验证浓H2SO4与木炭反应所得到的各种产物。这些装置的连接顺序(按产物气流从左到右的方法)是
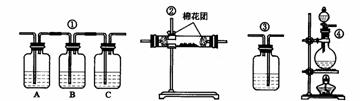


 ______________________________________________(填写装置的编号)。
______________________________________________(填写装置的编号)。
⑶实验时,可观察到装置①中A瓶的溶液褪色,C瓶溶液不褪色。则A瓶的作用是:
________________;B瓶的作用是:____________;C瓶的作用是:_______________________。
⑷装置②中所加固体药品是_________________,可验证的产物是________________。
⑸装置③中所盛的溶液是_____________________,可验证的产物是___________。
7.雷利是英国物理学家,他曾用下列两种方法测定氮气的密度。
方法一:将除去水蒸气和二氧化碳的空气通过烧红的装有铜屑的玻璃管,使空气中的氧气全部除去,测得氮气的密度为1.2572kg/L。
方法二:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成氮气和水蒸气,除去
水蒸气后测得氮气的密度为1.2508g/L。
若两次测定的状况相同,请问: (1)方法二中发生反应的化学方程式为 ;
(2)欲除去空气中的水蒸气和二氧化碳,可供选择的装置如下图所示(不可重复使
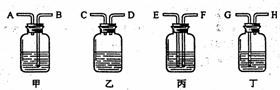 用),在你选择的装置中,用相应的字母表示导管口的连接顺序
,瓶中应盛放什么物质: 。
用),在你选择的装置中,用相应的字母表示导管口的连接顺序
,瓶中应盛放什么物质: 。
(3)请分析两种方法所测定的氮气密度数值不同的原因。
6.将适量黄色的草酸亚铁(FeC2O4·2H2O)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着的木条熄灭,生成黑色的粉末。反应将结束时,用橡皮塞塞好试管,稍冷后,打开塞子将所得的黑色粉末撒在石棉网上,便会立即自燃起来。试回答下列问题:(1)黑色粉末是什么物质?为什么在空气中自燃? 。
(2)反应将结束时,用橡皮塞塞好试管有何作用? 。
(3)化学反应的快慢与反应物的表面积有何关系? 。
(4)写出草酸亚铁受热分解的化学方程式。 。
5.某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
[实验原理]Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
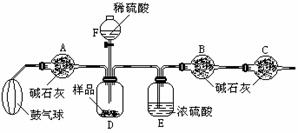 通过实验测定反应生成的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
通过实验测定反应生成的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
[实验装置]
[实验步骤]①如图连接装置(除B、C外)并加入所需药品;
②称量并记录B的质量(m1)。(称量时注意密闭B的两端)
③按动鼓气球,持续约1分钟;④连接上B、C;
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟;
⑦称量并记录B的质量(m2)。(称量时注意密闭B的两端及E右端的出口。)⑧计算。
(1)已知碱石灰的主要成分是氧化钙和氢氧化钠,则干燥管A的作用是______,干燥管C的作用是___________,E装置的作用是______,步骤③中鼓气的目的是______________;本实验能否同时省略③⑥两个步骤?_____原因是___________________________________;
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(ρ=1.07g/mL)_____mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为__________。
4. 为了检验在氢气和二氧化碳的混合气体中是否混入了一氧化碳,用如下的装置进行实验。请回答:
为了检验在氢气和二氧化碳的混合气体中是否混入了一氧化碳,用如下的装置进行实验。请回答:
(1) 装置B中用的试剂是 ___ ,目的是为了 。
(2)当观察到E装置中出现________现象时,说明混合气体中一定含有一氧化碳。
(3)如果混合气体中含有一氧化碳,为了保护环境,应在E装置右边的排气管口采取的措施是___ 。
(4)A装置的作用是________,反应的化学方程式是______ ____
(5)假设混合气体中的CO与CuO完全反应,当通入的气体为mg, D增重ng,E瓶增重pg。则混合气体中CO的质量百分数为: %;如果去掉D装置,这里计算的CO的质量百分数准确吗?为什么? ___ ___________ _。
3.某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分
数(铁架台、铁夹等在图中均已略去)。实验步骤如下:①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6g纯碱样品放入容器b中;④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不
再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的
总质量为85.6g。试回答:
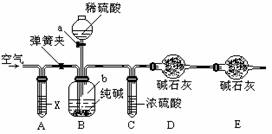
(1)若④⑤两步的实验操作太快,则会导致测定结果__(填“偏大”或“偏小”);
(2)鼓入空气的目的是______________________,装置A中试剂X应选用___;
(3)若没有C装置,则会导致测定结果_____(填“偏大”或“偏小”);
(4)E装置的作用是___________________________________;
(5)根据实验有关数据,计算纯碱样品Na2CO3质量分数为______(结果保留一位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com