
题目列表(包括答案和解析)
1、区分02、H2、C02三种气体的最简便的方法是 ( )
A.将气体通入澄清石灰水 B.将气体通过红热的铜网
C.将气体通过灼热的氧化铜 D.用燃着的木条伸入集气瓶中
33.(8分)现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并做有关记录。有关数据记录如下表:
|
加硫酸的序号 |
加硫酸的体积/mL |
剩余固体的质量/g |
|
1 |
20.0 |
16.0 |
|
2 |
20.0 |
12.0 |
|
3 |
20.0 |
8.0 |
|
4 |
20.0 |
8.0 |
试计算:
(1)10.0g此样品中铜的质量。
(2)样品中氧化亚铁的质量分数。
(3)所用硫酸溶液中溶质的质量分数。(计算结果精确到0.1%)
32.(8分)100m L Na2CO3溶液中含溶质A g,若加入含CaCl2的质量分数为10%的溶液B g,则溶液恰好显中性。求:
(1)A与B的比值。
(2)若改用其他试剂,为使反应后的溶液也恰好显中性,则应从溶质的质量分数均为10%的氢氧化钡溶液或盐酸中选用哪种试剂?它的质量是B g的多少倍?
30.(7分)物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象。某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:
(2)简述强调“测得的pH小于7”的理由:
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。该组同学在向NaOH溶液 中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红 色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上 方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油” 目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈 性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现
象。请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法
,②观察到的现象 。
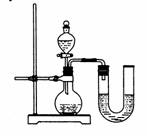
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果Na OH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。该组同学将不同浓度的盐酸和NaOH溶液各1 0 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后渝唐的升高值△t,(如下表)。
|
编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
|
1 |
3.65% |
2.00% |
3.5 |
|
2 |
3.65% |
4.00% |
X |
|
3 |
7.30% |
8.00% |
1 4 |
(1)表中x= 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。
3 1.(7分)设想你已设计并完成了一个简便可行的实验,以研究NaOH溶液(Na+、O2-、H2O)
中,哪种粒子使无色酚酞试液变红。请填写好如下实验报告:
实验目的:
实验药品:
实验仪器及其他:
|
实验步骤 |
现 象 |
分析推理过程(简述) |
结 论 |
|
|
|
|
|
29.(4分)某同学测定一瓶BaCl2溶液中溶质的质量分数,请回答实验中的有关问题:
(1)打开试剂瓶取出10.0g该溶液置于一个洁净的烧杯中。操作中,取下瓶塞 放在桌上,理由是 。
(2)用胶头滴管向烧杯中滴加AgNO3溶液直至不再产生沉淀为止。滴加试剂时,滴管要保持 ,不要接触 ,用毕立即用蒸馏水冲洗。
(3)过滤时,要用一根洁净的 ,下端轻轻地靠在 的滤纸那边,使液体混合物沿其缓缓流入过滤器。
(4)取沉淀物于蒸发皿中加热蒸干,在充分干燥之后称量,得到沉淀物的质量是0.2g,则氯化钡溶液中溶质的质量分数为 %。(计算结果精确到0.1%)
28.(3分)据报道,科学家在深海发现了一种外表象冰的固态物质,这种物质的成分是甲烷水合物(CH4·xH2O),称为可燃冰。通常状况下,这种物质不稳定、易分解、易燃,在低温或高压下呈固态。其储量超过煤和石油的总储量,是很有前途的待开发能源。
(1)请你分析可燃冰作为能源有什么优点?
(2)科学家对在我国南海海域发现的可燃冰的组分进行研究后,测得其含碳的质量分数 为7.5%,则x的值为 。
(3)测得这种晶体的结构为平均每46个水分子建8个笼,每个笼中容一个甲烷分子或一
个游离的水分子则在这种晶体中共含 种分子。若每8个笼容有6个甲烷和2个水分子,
则在这8个笼组成的整体中,甲烷与水的分子个数比是 。
27.(4分)某同学用一定溶质质量分数的稀硫酸做“氧化铜+硫酸→硫酸铜+水”的实验,其五次实验结果如下表所示:
|
实验次数 |
氧化铜/g |
硫酸溶液/g |
硫酸铜/g |
|
1 |
2.0 |
120 |
4.0 |
|
2 |
4.0 |
120 |
8.0 |
|
3 |
6.0 |
120 |
9.6 |
|
4 |
8.0 |
200 |
16.0 |
|
5 |
10.0 |
200 |
x |
根据实验结果填写下列空格:
(1)哪几次反应氧化铜有剩余? 。
(2)哪几次反应硫酸有剩余? 。
(3)表中x的值是 。
(4)硫酸溶液中溶质的质量分数为 。
26.(4分)小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但同学告诉她菠菜不能与豆腐同食。
[发现问题]菠菜为什么不能与豆腐同食?
[查阅资料]a.制作豆腐需要加入石膏(主要成分:CaSO4);b.菠菜中含有草酸、草酸盐等成分;c.草酸钙是一种既不溶于水也不溶于醋酸的白色固体,是诱发人体结石的物质之一
[提出猜想]菠菜与豆腐同食可能会产生人体不能吸收的沉淀物。
[设计实验]
|
实验步骤 |
实验现象 |
实验结论 |
|
①将菠菜在少量开水中煮沸2-3min,取l-2mL滤液于试管中,并滴加少量 溶液. |
产生白色沉淀 |
有草酸钙生成 |
|
②在步骤①的沉淀物中加入过量醋酸 |
沉淀部分溶解,且产生气泡 |
被溶解的沉淀一定 不是 |
[发现新问题]被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:
|
实验步骤 |
实验现象 |
实验结论 |
|
③将步骤②产生的气体通入 中 |
|
产生的气体是
;步骤②被溶解的沉淀是碳酸钙 |
[反思与应用]
(1)家庭中常常将菠菜放在开水中烫过后再烹饪,其目的是
(2)联想到人体胃液中含有盐酸,请提出一个你想要探究的关于食用波菜的新问题:
25.(3分)据济南市疾病预防控制中心2007年5月11日发布的消息,目前济南市除商河、济阳两县外,其它八个县(市、区)均为缺碘地区。专家提醒,成人每天吃6g加碘盐就可满足人的生理需要。生产加碘盐通常是在食盐中加入碘酸钾(KIO3)。试回答下列问题:
(1)碘酸钾是由 种元素组成。
(2)在KIO3中碘元素的化合价是 价。
(3)为检验某食用盐试样中是否含有碘元素,某同学确定采用以下反应进行实验:
KIO3+5KI+3H2SO4(稀)==3I2+3K2SO4+3H2O,要达到实验目的,除了KI、稀硫酸外,他还应选用的一种试剂是下列中的 (填序号)。
①淀粉溶液 ②NaCl溶液 ③K2SO4溶液 ④NaOH溶液
24.(3分)金属钛因为有神奇的性能越来越引起人们的关注,常温下钛不与非金属及强酸反应,加热时却可以和常见的非金属单质反应。钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)使金红石与碳粉混合,在高温条件下反应,再通入氯气,制得TiCl4和一种可燃性气体。
该反应的化学方程式为 。该反应的还原剂是 。
(2)在氩气的气流中,高温下用过最的镁跟TiCl4反应制得钛。
写出此反应的化学方程式: 。
(3)从上述反应的混合物中分离出金属钛。请写出简要的分离步骤和相关的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com