
题目列表(包括答案和解析)
20、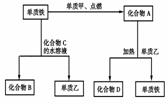 根据下列物质的转化关系回答:其中化合物A为黑色固体,化合物C由两种元素组成。
根据下列物质的转化关系回答:其中化合物A为黑色固体,化合物C由两种元素组成。

19、
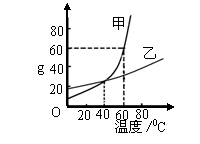 溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
(1) 20℃时,甲物质的溶解度_____ (填“大于”、“等于”或“小
于”)乙物质的溶解度。(2) _______ ℃时,两种物质的溶解度相等。
(3) 60℃时,将80 g 甲物质放入100 g水中,所得溶液的溶质质量分数为 。
18、如图所示,在试管和小气球中分别先加入无色液体和一种常见的固体物质,然后将气球中的固体物质倒入试管中,观察到有气泡产生且气球胀大。将气球小心取下用细线将气球口扎紧,气球能在空气中下沉,则气球中加入的固体物质与盐酸反应的化学方程式可能是______________________________。
17、如图所示,为等质量的A、B、C与足量相同浓度的稀硫酸反应的关系。横坐标表示反应时间,纵坐标表示生成氢气的质量。据此分析:

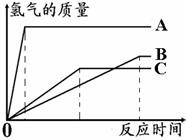
(1)等质量的三种金属与足量稀硫酸反应产生氢气的质量最少的金属是_______;
(2)三种金属的金属活动性顺序由强到弱为________________;
16、十八世纪六十年代,英国化学家卡文迪许在实验室用金属锌和稀盐酸制得氢气和氯化锌,并用排水的方法收集到了氢气。初期,氢气被用于飞艇和载人气球。后因失火、爆炸等原因,人们改用氦气填充飞艇。后来,工业上主要用它来和氮气反应制取氨气(NH3);还可以用来制备金属,例如用氧化铜和氢气加热得到水和金属铜。研究发现,氢气燃烧时放出大量热,是等质量汽油燃烧放热的3倍;氢气燃烧后的产物是水,不会造成污染。因此,氢气将成为最有前景的能源。目前,工业上人们常用水和高温的焦炭(C)反应制得氢气和一氧化碳。 通过学习知道,物质的性质决定物质的应用,如上介绍了一些氢气的应用知识,请在表中写出相对的氢气的性质。(用简要的文字表述)
|
氢气的性质的应用 |
氢气对应的性质 |
|
1)用排水的方法收集氢气 |
|
|
2)氢气被用于飞艇和载人气球 |
|
|
3)氢气用来制金属铜 |
|
|
4)氢气将成为最有前景的能源 |
|
15、在下列概念:A单质、B化合物、C氧化物、D元素、E化合反应、F分解反应、G化学性质、H物理性质中,选择适宜的选项的字母代号填空:1827年月,德国科学家韦勒将钾与无水氯化铝一起加热制得金属铝。金属铝是 。铝是银白色、有光泽的金属。密度为2.70g/cm3,熔点为660.37℃,沸点为2467℃。铝具有良好的导电性、传热性和延展性。这是铝的 。铝是活泼金属,在空气中会形成致密氧化层,不能与水、氧气继续作用。高温下可与氧气反应,产生大量的热:4Al+3O2加热2Al2O3,氧化铝是 ;该反应是 反应。高温下铝也可以与非金属反应,也可溶于酸或碱。在刚玉(天然氧化铝晶体)、明矾(K2Al2(SO4)4·24H2O)中,铝元素以___________形式存在。
14、常温下,向10L真空容器中通入agH2和16gO2(a、b都是正整数,且a≤5, b≤5)反应完全后, 容器中可能达到的最大密度约是( )
A.0.3g/L B.7.2 g/L C.4.0 g/L D.8.0 g/L
13、甲.乙.丙.丁四个烧杯中分别放入2.4gMg、4gMgO、5.8gMg(OH)2、8.4gMgCO3, 分别加入稀硫酸,使它们刚好完全反应,则反应后溶液的容质质量分数为( )
A. 甲 >乙>丙>丁 B.丁>丙> 乙> 甲
C. 甲 >乙=丁>丙 D. 丙>丁=乙> 甲
12、下列区分各组物质的方法不可行的是( )
A.用水区分:氢氧化钠固体、硝酸铵固体、氯化钠固体
B.用紫色石蕊试液区分:Na2CO3、NaOH、Ba(OH)2、NaCl、H2SO4、BaCl2六种溶液
C.通入二氧化碳和升温两种方法都能区分:氢氧化钠溶液和饱和石灰水
D.不用试剂可区分:NaOH NaNO3 NaCl HCl CuCl2五种溶液
11、小聪想配制50g 5%的氯化钠溶液并验证其酸碱性,他设计了如下实验步骤,请你指出他错误的操作之处共有( )
(1)计算:配制50g 5%的氯化钠溶液需氯化钠2.5g、水45g;(2)称量:先用量筒量取所需的水,然后按左盘放砝码右盘放物体称取所需量的粗盐,最后将称得的盐倒入量筒中,用玻棒搅拌使其充分溶解;(3)将预先用水润湿的pH试纸上,伸入到配得的溶液中测定其pH。
A.3 B.4 C.5 D.6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com