
题目列表(包括答案和解析)
5.化学式的书写
(1)氧化物的化学式书写: 在右,例如,二氧化碳: ,氧化镁: ,
(2)一般化合物书写:金属元素的符号在 ,非金属元素的符号在 。
例如,氯化钠: ,氧化铁: ,硫酸铝: ,氯化锌
(3)用化合价原则书写:一般正价在 ,负价在 。
例如:氯化氢: ,氧化汞: ,碳酸镁: ,过氧化氢:
4.化合价与离子符号的书写有一定的区别:
|
化合价 |
离子 |
|
|
表示方法 |
用+1、+2、-1、-2……表示标在元素符号的正上方(“1”不省) |
用+、2+、-、2-……表示标在元素符号右上角(“1”省去) |
|
实例 |
+1 -1-1 +2 Na、Cl、OH、Ca |
Na+、Mg2+、Al3+、Cl-、SO42- |
|
联系与区别 |
同种元素(或原子团)的化合价和离子电荷通常在数值上相等,位置不同,正、负号的写法不同。 |
3.化合价。
化合物均有固定的组成,即形成化合物的元素有固定的原子个数比,化学上用“化合价”表示原子间相互化合的数目。
(1)化合价的一般规律:
①化合价有正价和负价。
a.氧元素通常显 价;
b.氢元素通常显 价;
c.金属元素跟非金属元素化合时,金属元素显 价,非金属元素显 价;
d.一些元素在不同的化合物中可显不同的化合价。
②在化合物里正、负化合价的代数和为 。
③元素的化合价是元素的原子在相互形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为 。
(2)常见元素及原子团的化合价:
|
+1价 |
K、Na、H、Ag、NH4 |
+2价 |
Ca、Mg、Ba、Zn、Cu |
|
-1价 |
F、Cl、I、OH、NO3 |
-2价 |
O、S、SO4、CO3 |
2.化学式的书写根据。
(1)因为物质的组成是通过实验测定的,因此化学式的书写必须依据实验结果。
(2)还可以应用元素的化合价来推求。
1.化学式。用元素符号表示物质组成的式子叫化学式。
(1)化学式的意义(以H2O为例):
|
分类 |
意义 |
实例 |
|
宏观 |
①表示一种物质 |
水 |
|
①表不该物质组成元素 |
水是由H、O两种元素组成的 |
|
|
微观 |
①表示物质的一个分子 |
一个水分子 |
|
②表示物质的分子构成 |
每个水分于是由2个氢原子和1个氧原子构成 |
如:
写出下列符号的意义:
3Fe ,5Al2O3 ,2H2 .
写出下列化学语的符号:4个钠离子: ,2个氯气分子: ,氮气 , 4个硫酸分子: ,氧元素: ,3个碳酸钠分子:
4.物质的构成与组成:
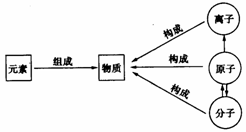
(1)纯净物是由同种或不同种 组成的。
(2)大多数纯净物是由分子构成的,如氧气、水……
(3)少数物质是由原子构成的,如铁、氖气等。
(4)还有少数物质是由离子构成的。如NaCl是由Na+和Cl-构成……
课题4 化学式与化合价
3.离子与原子的区别和联系:
|
粒子种类 |
原子 |
离子 |
||
|
阳离子 |
阴离子 |
|||
|
区别 |
粒子结构 |
质子数=核外电子数 |
质子数>核外电子数 |
质子数<核外电子数 |
|
粒子电性 |
不显电性 |
显正电性 |
显负电性 |
|
|
符号 |
用元素符号表示如Na、Cl |
用阳离子符号表示如Na+、Mg2+ |
用阴离子符号表示如Cl-、S2- |
|
|
联系 |
阳离子  原子 原子  阴离子 阴离子 |
2.离子的形成。
(1)离子:因得失电子而带电荷的原子叫离子。如Na+、Cl-、OH-、SO42-等
(2)离子的分类。
 阳离子:带正电的离子
阳离子:带正电的离子
离子
阴离子:带负电的离子
写法:在元素符号的右上角标明电量和电性(电量为1的可省略不写)
如:Na+、Mg2+、Al3+;Cl-、S2-、O2-……
碳酸根离子: ,氢离子: ,2个亚铁离子: ,5个钙离子:
下列符号表示的意义:NO3-: ,7Fe3+ ,2H+
(3)离子符号及其意义(数字“2”的意义)。
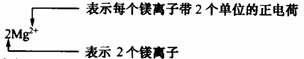
例如,指出下列符号中数字的意义:Fe2+
nCO2 , 3Cl-
5SO42-
(4)化合物的形成过程(以NaCl为例。)

1.核外电子的排布。
(1)核外电子的分层排布:元素的原子核外的电子层最少有1层,最多有7层;第一层不超过个 电子,第二层不超过 个电子,最外层不超过 个电子(只有1个电子层的最外层不超过2个电子)。
(2)原子结构简图各部分的意义:
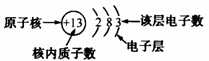
(3)相对稳定结构:最外层具有 电子(只有一个电子层的元素具有2个电子)的结构属于相对稳定结构。
(4)元素性质与元素最外层电子数的关系:
|
元素分类 |
最外层电子数 |
得失电子倾向 |
化学性质 |
|
稀有气体元素 |
8个(He为2个) |
不易得失、相对稳定 |
稳定 |
|
金属元素 |
一般 4个 |
易 最外层电子 |
不稳定 |
|
非金属元素 |
一般 个 |
易 电子 |
不稳定 |
(5)元素的性质,特别是元素的化学性质,是由 决定的。
3.元素周期表。
根据元素的原子结构和性质,把现在已知的一百多种元素按原子序数(核电荷数)科学有序的排列起来,这样得到的表叫元素周期表。
(1)元素周期表的结构:
①每-格:在元素周期表中,每一种元素均占据一格.对于每一格,均包括原子序数、元素符号、元素名称、相对原子质量等内容。此外在周期表中,还用不同的颜色对金属元素、非金属元素做了区分。
②每一横行(即: ):周期表每一横行叫做-个周期。共有 个横行,有 个周期。
③每-纵行(即 ):周期表的18个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一个族,共有16个族。
(2)元素周期表的意义:学习和研究化学的重要工具
①为寻找新元素提供了理论依据。
②由于在周期表中位置越靠近的元素性质越相似,可启发人们在元素周期表一定的区域寻找新物质所需的元素,(如农药、催化剂、半导体材料等。)
课题3 离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com