
题目列表(包括答案和解析)
15. (6分)人胃酸过多会引起胃病。下图为某抗酸药包装标签上的部分文字,请回答下列问题。
(6分)人胃酸过多会引起胃病。下图为某抗酸药包装标签上的部分文字,请回答下列问题。
(1)该药“嚼碎后吞服”的原因
是_____________________ 。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下操作:取一片药片(药片质量为0.5g)研碎后加20ml蒸馏水,然后用质量分数为5%、密度为1.02g/ml的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0ml,通过计算:
①判断该药片中氢氧化铝的含量是否达到标注?
②确定该药片中氢氧化铝的质量分数是多少?
综合四
14.(9分)探究海洋资源的综合利用
镁将成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源。
 (1)占地球表面积70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
(1)占地球表面积70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
①在实验室进行过滤操作时需要用到玻璃棒,其作用是_____________________。
②电解熔融氯化镁的过程中,_______能转化为_______能。
(2)金属镁是一种较活泼金属,在二氧化碳气体中也能燃烧。燃烧的化学方程式为2Mg+CO2 点燃C+2MgO,此反应类型属于_______。
A.分解反应 B.化合反应 C.复分解反应 D.置换反应
(3)镁铝合金广泛应用于火箭、导弹等。某兴趣小组为探究镁铝合金的组成,取16g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中(铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁与氢氧化钠溶液不反应),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
|
所加氢氧化钠溶液的次数 |
第一次 |
第二次 |
第三次 |
|
剩余固体的质量/g |
10.6 |
5.2 |
4.0 |
从以上数据可知,该合金中镁元素与铝元素的质量比为______________。所用氢氧化钠溶液的溶质质量分数为_______。
(4)老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属。但拿出的镁条总是有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?
猜想:小明认为可能是氧化镁;小赵认为可能是Mg2(OH)2CO3,小花认为可能是氢氧化镁。小赵认为小明的猜想是错误的,其理由是____________________________。
实验探究:小赵对灰黑色物质进行加热,发现试管口有液滴出现,收集的气体能使澄清石灰水变浑浊,同时试管内生成白色固体。
实验分析:实验后,小赵认为小花的猜测也是错误的,其理由是______________。
查阅资料得出结论:Mg2(OH)2CO3和氢氧化镁都可以加热分解,产物均为氧化物,据此请你写出Mg2(OH)2CO3分解的化学方程式____________________________。
13.(9分)追寻科学家的足迹
实验室里某小组正在探究一个问题。根据设计方案,小英向试管中加入2ml氢氧化钠溶液,滴入几滴酚酞试液,溶液显红色。然后她又用滴管连续滴入一定量的稀硫酸,溶液由红色变为无色。
(1)他们探究的问题是_______。
① 酚酞试液遇酸、碱溶液能显示不同颜色吗?
② 酸和碱溶液能发生反应吗?
(2)大家对小英得到的无色溶液继续探究。小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是_____________________。
同学们根据以下两种方案进行实验后,一致认为小亮的观点是正确的。请你补填下表的空白。
|
实验操作 |
实验现象 |
实验结论 |
|
方案一:取少许反应的溶液置于试管中,向其中加入_______ |
|
小亮的观点正确 |
|
方案二:取少许反应的溶液置于试管中,向其中加入_______ |
|
(3)请你和全组同学一起分析以下问题。

①稀硫酸和氢氧化钠溶液反应的微观过程如图1所示。从粒子的角度具体分析该反应发生的原因是_______ 。
②锌和硫酸铜溶液发生反应的微观过程如图2所示。从粒子的角度具体分析该变化是化学变化的原因是_______ 。
③通过以上分析,揭示出化学反应的微观本质是_______ 。
12. (15分)生活中的化学
(15分)生活中的化学
[问题一]某同学晚上帮妈妈做饭,切完青菜就将菜刀放在菜板上,第二天早晨发现菜刀生锈了。试问:
(1)菜刀上是否发生了化学变化?______________。
(2)为了防止菜刀生锈,你的建议是___________________________________。
[问题二]多数同学家中都有一些劳动工具,例如镰刀,不用时若保存不善就易生锈。试问:铁制劳动工具为什么会生锈?___________________________________。
[问题三]小新同学发现铜制的眼镜框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3 。
[提出问题]铜是在什么条件下锈蚀的?
[猜想]根据铜锈的化学式,猜想铜生锈可能是铜与水、_______、_______共同作用的结果。
[设计与实验]借鉴“铁钉锈蚀条件” 的探究实验如图所示:
 (1)实验较长时间后,发现_______试管中的光亮铜片最先生锈(填字母编号)。
(1)实验较长时间后,发现_______试管中的光亮铜片最先生锈(填字母编号)。
(2)从优化实验的角度考虑,A实验是多余的,它只考虑了水这个单一的条件。C试管中除光亮铜片、蒸馏水外,还有的另外一种物质为_______。
(3)D试管中除光亮铜片外,还有的另外两种物质为______________;从D试管的实验中,获得的结论是___________________________________。
[评价与改进]我认为小新设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确的结论,还要补充的实验是_____________________。
[反思与小结]通过铜片锈蚀条件的探究实验,我获得的启示是______________。
[问题四]小明找到了分别用纯铜、青铜(Cu、Sn合金)两种材料制作的四喜娃娃。
(1)怎样用化学方法区分这两种四喜娃娃?__________________________________。
(2)那种四喜娃娃更容易生锈?
小明发现从不同地点收集到的两个四喜娃娃中,青铜娃娃身上的锈斑比纯铜得多,他据此得出结论:青铜比纯铜更容易生锈。他的这种推理方法是否科学?______________。请说出理由:____________________________。
(3)青铜四喜娃娃的铜绿中为什么会有褐色的锈斑?
由于有的青铜中含杂质较多,尤其是含铁,故在铜绿间还会有斑驳的、呈褐色的氧化铁。现有一些这种含褐色的锈斑粉末,请你设计实验证明锈斑粉末中含有铁元素。________________________________________________________。
11.(4分) “探险队员”-----硫酸,不小心走进了有许多“吃人的野兽”(即能与硫酸发生化学反应的物质)的小山,请你帮助它走出小山(请用图中物质前的序号连接起来表示所走的路线):入口→_______→_______→_______→_______→出口。
10.(5分)某同学想探究酸碱中和反应是放热反应。进行下列实验操作:取溶质质量分数为20%的稀硫酸30ml,用温度计测出其温度为13℃。然后向其中加入NaOH固体,再用温度计测出温度为22℃。由此,该同学得出NaOH与稀硫酸发生的中和反应是放热反应的结论。请回答下列问题:
(1)该同学所得的结论的依据是否科学?理由是_____________________ 。
(2)根据本实验的目的,请你改进他的实验操作____________________________。
(3)萧宏同学取反应后的溶液,向其中滴入酚酞试液,发现酚酞试液不变色。因此他得出溶液呈中性的结论。你为他的结论是否正确?______ _,理由是_____________________。他应补做得实验是____________________________。
9.(8分)实验中学同学开展复分解反应研究性学习,设计了如下研究性学习思路:
[练习质疑]下列各组物质间均能反应,写出③、④反应的化学方程式。
①氢氧化钠溶液与盐酸 ②碳酸钠溶液与硫酸
③硫酸铜溶液和氢氧化钠溶液 。
④碳酸钠溶液和氯化钡溶液 。
[研究讨论]上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,
如①中有H+和OH- ,②中有H+和CO32-,③中有 ,④中有 。
[构建网络]按照一定的顺序排列这些离子,就可以形成一种网络形式。在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水。现有Ca2+、SO42-、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络。
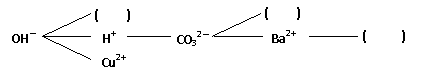 [拓展运用]通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等。如硫酸钠溶液混有硫酸铵,可以加入
(填写化学式)除去硫酸铵。
[拓展运用]通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等。如硫酸钠溶液混有硫酸铵,可以加入
(填写化学式)除去硫酸铵。
8.在一个萝卜上挖一个大孔,向其中注入饱和食盐水,一段时间后将食盐水倒出,在相同的温度下,发现倒出的溶液还可溶解少量的食盐,这说明倒出的溶液………( )
A.是饱和溶液 B.是不饱和溶液C.氯化钠溶解度升高 D.氯化钠溶解度降低
7.下图是分离与提纯海水的流程:

下列有关认识错误的是……………………………………………………………( )
A.常用于淡化海水的方法有蒸馏法、过滤法等
B.粗盐提纯为较纯净的食盐晶体的操作为:溶解、过滤、蒸发
C.通常在苦卤中加入熟石灰制取氢氧化镁
D.海水中的食盐用途广泛,例如侯德榜利用食盐为原料制得了纯碱
6.将一定量的铁粉加入到一定量的硝酸银、硝酸铜及硝酸锌的混合溶液中,待充分反应后过滤,向滤渣中加入稀硫酸,没有气体产生,则在滤液中…………………( )
A.只有硝酸锌和水 B.一定有硝酸锌和硝酸亚铁
C.一定没有硝酸银 D.一定没有硝酸铜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com