
题目列表(包括答案和解析)
1、成语是中华文化中的瑰宝,下列成语中蕴含化学变化的是
A.滴水成冰 B.聚沙成塔 C.百炼成钢 D.刻舟求剑
29.现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示。请根据有关信息计算:
|
硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈。他在配制
该溶液时所用98%的浓硫酸与水的质量比应该为 ▲ 。
⑵某固体物质由氯化钠和氯化钡混合组成,取32.8g该固体混
 合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如下图所示关系,计算32.8g固体混合物中氯化钡和氯化钠的质量。
合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如下图所示关系,计算32.8g固体混合物中氯化钡和氯化钠的质量。
⑶若加入的稀硫酸刚好使沉淀最大量时,将所得混合物
过滤、洗涤,得滤液200g(过程中损耗忽略不计),
计算该滤液中溶质HCl的质量分数。(若溶液中含有多种
溶质,则某溶质的质量分数为该溶质的质量与溶液总
质量之比)
(反应的方程是为:BaCl2 + H2SO4 = BaSO4↓ + 2HCl)
(注:⑵、⑶两问将计算过程写在答卷纸上)
我很自信:我已认真检查过自己的答题,一定会取得理想的成绩!
28.(10分)小杰和小燕学习了碳单质的化学性质后,知道碳与氧气反应,若反应物的量不同,生成物不同。于是两人联想到木炭粉与氧化铜发生的反应可能有:
①C+2CuO 2Cu+CO2↑
②C+CuO
2Cu+CO2↑
②C+CuO Cu+CO↑
Cu+CO↑
他们想来验证自己的想法,请你和他们一起进行探究:(请完成下列空白处)
[提出问题]木碳与氧化铜反应除生成单质铜外,另一种生成物是什么?
[猜想与假设]木炭粉与氧化铜反应生成物有三种可能:
⑴产物是铜和一氧化碳 ⑵产物是铜和二氧化碳 ⑶产物是 ①▲ 。
[设计方案]
⑴检验CO2的方法是 ②▲ 。(用方程式表示)
⑵如何检验产物中是否存在CO,两位同学分别提出了检验CO的方案,但都被大家否定了。请在下表中写出不可行的原因。
|
|
检验方案 |
不可行的原因 |
|
小杰 |
把小动物放在收集的气体中,观察能否存活 |
③▲ |
|
小燕 |
点燃生成的气体,观察能否燃烧 |
④▲ |
查阅资料后,他们把滤纸浸泡在磷钼酸与氯化钯的黄色混合液中,制成试纸(试纸遇一氧化碳立刻变蓝,而遇二氧化碳不反应)
[实验结论]设计的实验装置(如下图1):
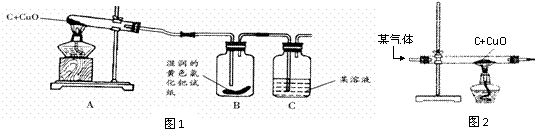
|
实验现象 |
实验结论 |
|
A中固体由黑色变成红色 |
有Cu生成 |
|
B中黄色试纸变蓝 |
有 ⑤▲ 生成 |
|
C中 ⑥▲ |
有CO2生成 |
[反思与评价]
⑴如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是 ⑦▲ 。
⑵实验结束时,为防止铜被氧化,必须先停止加热,待铜冷却后再将试管口的橡皮塞取下,因此若没有B试剂瓶,可能导致的后果是 ⑧▲ 。
⑶根据实验结论,从环保的角度考虑,上述装置C后应添加的装置是 ⑨▲ 。
[拓展与交流]
如果用如图2装置代替图1中的A装置,这样既可以排尽试管中的空气,又能将反应产生的气体都“赶”出来,该气体可能是 ⑩▲ 。
27.(8分)举世瞩目的2008北京奥运会将于今年8月8日正式拉开序幕,化学在2008北京奥运会的各个方面正发挥着巨大的作用。
 ⑴北京奥运会需要大量的材料。下列应用中主要使用金属材料的是 ▲
(填序号,下同),主要使用有机高分子材料的是 ▲ ;
⑴北京奥运会需要大量的材料。下列应用中主要使用金属材料的是 ▲
(填序号,下同),主要使用有机高分子材料的是 ▲ ;
⑵用于建造主体育场-“鸟巢”的钢铁表面都涂上了一层叫做“聚四氟乙烯”的物质,可以保证50年不生锈,其主要的防锈原理是 ▲ ;
采用何种方法区分用于制作福娃的聚酯纤维和纯羊毛绒? ▲ ;
⑶北京奥运会对能量的需求量很大,人类通过化学反应获得的能量,大多来自于 ▲ 、石油和煤等化石燃料。北京市在开发和使用新能源上进行了很多尝试。例如,在街头使用一种不用外接电源的路灯和交通指示灯,只要每天有短时间的光照即可,上述路灯和指示灯使用的能源是 ▲ 。
⑷为体现绿色奥运的理念,北京奥运会采用丙烷(C3H8)作火炬燃料。丙烷燃烧发出亮黄色火焰,反应生成水和二氧化碳,该反应的化学方程式为 ▲ 。
⑸北京奥运会将有数以万计的观众。针对观看比赛时产生的垃圾,下列说法正确的是 ▲ 。
①这些垃圾应随身带出赛场,分类回收
②这些垃圾可送到垃圾焚烧发电厂,焚烧发电
③这些垃圾中的塑料制品不要随意丢弃,避免“白色污染”
26.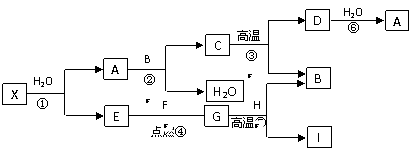 (6分)学习化学要求熟悉物质的性质以及物质之间的相互转化。含钙氧化物X是一种安全无毒的物质,常用于长途运输时鲜活鱼的供养剂。已知X含有的两种元素的质量比为5:4.由X出发有下列转化关系,其中⑤是冶炼得到目前使用最广泛的金属I的反应,B、E、G是常见的气体,E、F是非金属单质,F为黑色固体,B能使澄清石灰水变浑浊。回答下列问题:
(6分)学习化学要求熟悉物质的性质以及物质之间的相互转化。含钙氧化物X是一种安全无毒的物质,常用于长途运输时鲜活鱼的供养剂。已知X含有的两种元素的质量比为5:4.由X出发有下列转化关系,其中⑤是冶炼得到目前使用最广泛的金属I的反应,B、E、G是常见的气体,E、F是非金属单质,F为黑色固体,B能使澄清石灰水变浑浊。回答下列问题:
⑴写出有关物质的化学式D ▲ ,E ▲ ,X ▲ ;
⑵指出C物质的一种用途 ▲ ;
⑶写出反应③的化学方程式 ▲ ;
写出反应⑤的化学方程式 ▲ 。
25.(13分)“碳铵”(NH4HCO3)是一种常用的化学肥料,易溶于水,受潮时在常温下就能分解,温度越高分解越快,分解产物为NH3、CO2、H2O。“碳铵”遇碱放出氨气,在土壤中不残留有害物质。
⑴“碳铵”属于化肥中的 ▲ 肥,化学性质 ▲ (填“稳定”或“不稳定”);保存时应
注意 ▲ 。(选填序号)
①贮存和运输时要密封,不要受潮和曝晒;施用后要立即盖土或立即灌溉
②不要与碱性物质混放或混用
③不能与易燃物质混在一起;结块时,不要用铁锤砸碎
④不宜长期施用
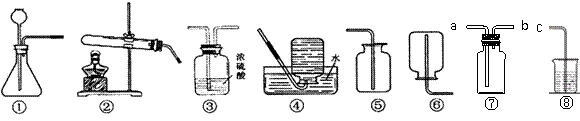 某兴趣小组欲在实验室利用如下图所示的装置研究“碳铵”的部分性质,请你一起参与。
某兴趣小组欲在实验室利用如下图所示的装置研究“碳铵”的部分性质,请你一起参与。
⑵选择装置 ▲ (填序号)进行“碳铵”固体受热分解的实验,该反应的化学方程式为
▲ ;应用该装置,还可以在实验室进行的实验是 ▲ 。(答一个即可)
⑶利用装置①,写出实验室制取一种气体的化学方程式 ▲ ,收集该气体的装置应选择 ▲ 。
⑷取少量“碳铵”和熟石灰粉末放入装置②的大试管中,微热片刻立即移开酒精灯。将产生的氨气缓缓通入盛有酚酞试液的试管中,酚酞试液变红。
①由此可知,氨气易溶于水,其水溶液(氨水)显 ▲ 性(填“酸”、“碱”或“中”),pH ▲ 7(填“<”、“>”或“=”)。
②某同学认为可用装置③干燥氨气你认为他能否达到目的?简要分析原因。
▲ ;
③由于氨气具有强烈的刺激性气味,对人体的呼吸道粘膜有较大的伤害,我们可以选用上述的装置中的⑦和⑧连接收集并吸收逸散出来的多余氨气,则应将 ▲ (选填“a”或“ b”)与c相连接,烧杯中应盛放 ▲ 。
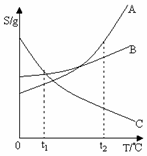
24.(3分)右图是A、B、C三种固体物质的溶解度曲线,请根据曲线回答:
⑴t2℃时,将三种物质分别溶于100g水中制成饱和溶液,(此时溶液中
无固体物质存在)需要溶质质量最多的是 ▲ ;
⑵将上述制成的饱和溶液分别由t2℃降温至t1℃后,析出晶体
最多的是 ▲ ;
⑶上述饱和溶液由t2℃降温至t1℃后的三种溶液中溶质的质量分数
最小的是 ▲ 。
23.(4分)每到冬天,市场上便有一种“热宝”出售,它是一个装有化学药品的小袋。使用时,撕去它的保护膜贴在身体上,不久便会产生热量。已知小袋中装有铁粉、碳粉和少量氯化钠。
⑴取小袋内物质,加入稀盐酸中,发生反应的化学方程式为: ▲ 。
⑵将袋内物质放在足量O2中燃烧,写出反应的化学方程式:
① ▲ ; ② ▲ 。
 ⑶将袋内物质加入一定量的CuSO4溶液中,充分反应后过滤,滤液中的溶质一定有 ▲ 。
⑶将袋内物质加入一定量的CuSO4溶液中,充分反应后过滤,滤液中的溶质一定有 ▲ 。
(填写化学式,有几种填几种)。
22.(2分)高纯度的单质硅是信息产业的核心材料,没有硅就没有你喜欢的计算机。请用你学过的知识回答下列问题:
⑴地壳中含有大量的硅元素,它的含量仅次于 ▲ 元素。
⑵SiO2是沙的主要成分,工业上制取粗硅的化学方程式为:SiO2+2C
 Si+2R,R的化学式为
Si+2R,R的化学式为
▲ ;该化学反应的基本类型是下列中的 ▲ 。
①化合反应 ②分解反应 ③置换反应 ④复分解反应
⑶硅能在O2中燃烧生成SiO2,并放出大量的热,有科学家正研究将硅作为新能源。与化石能源相比较,硅燃烧没有CO2排放,因而有助于解决的环境问题中的 ▲ 。
21.(4分)小明同学建设自己的家庭小实验室时收集了下列物质。请你按要求选择合适物质的序号填空 :
①活性炭 ②碳酸氢钠 ③食盐 ④纯碱 ⑤熟石灰
⑥烧碱 ⑦酒精 ⑧葡萄糖 ⑨干冰 ⑩氮气
发酵粉可以使食品松软可口,属于发酵粉成份之一,生活中人们称之为小苏打的是 ▲ ;常用来改良酸性土壤的碱是 ▲ ;我国著名化工专家侯德榜研究成功的“侯氏制碱法”所生产的“碱”是 ▲ ;可用来去除冰箱异味的是 ▲ ;生产上可以用作食品保护气的是 ▲ ;属于人体重要的供能物质是 ▲ ;可用于人工降雨的物质是 ▲ ;化学实验室常用的燃料是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com