
题目列表(包括答案和解析)
1.下列关于人体细胞代谢场所的叙述,正确的是
A.乳酸产生的场所是线粒体
B.雌性激素合成的场所是核糖体
C.血红蛋白合成的场所是高尔基体
D.胰岛素基因转录的场所是细胞核
32.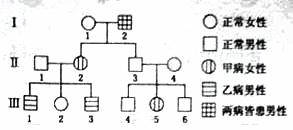 (18分)以下为某家族甲病(设基因为B、b)和乙病(设基因为D、d)的遗传家系图,期中II1,不携带乙病的致病基因。
(18分)以下为某家族甲病(设基因为B、b)和乙病(设基因为D、d)的遗传家系图,期中II1,不携带乙病的致病基因。
请回答:
(1)甲病的遗传方式是)甲病的遗传方式 ,乙病的遗传方式为 。I1的基因型是 。
(2)在仅考虑乙病的情况下,III2 与一男性为双亲,生育了一个患乙病的女孩。若这对夫妇再生育,请推测子女的可能情况,用遗传图解表示。
(3)B基因可编码瘦素蛋白。转录时,首先与B基因启动部位结合的醇是 。B基因刚转录出来的RNA全长有4500个碱基,而翻译成的瘦素蛋白仅由167个氨基酸组成,说明 。翻译时,一个核糖体从起始密码子到达终止密码子约需4秒钟,实际上合成100个瘦素蛋白分子所需的时间约为1分钟,其原因是 。若B基因中编码第105位精氨酸的GCT突变成ACT,翻译就此终止,由此推断,mRNA上的 为终止密码子。
31.(12分)为了探究某物质(X)的作用,研究者提出了以下实验思路:
(1)实验分组:
甲组:培养液+Y细胞+3H-TdR(3H标记的胸腺嘧啶脱氧核苷)+生理盐水
乙组:培养液+Y细胞3H-TdR+X(用生理盐水配制)
每组设置若干个重复样品。
(2)分别测定两组的CRD(细胞内的放射性强度),求每组的平均值。
(4)将各样品在适宜条件下培养合适时间后,测定CRD,求每组平均值并进行统计分析。
(要求与说明:答题时用X、CRD、3H-TDR表示相关名词:Y细胞是能增值的高等动物体细胞)请回答:
(1)实验目的: 。
(2)预测实验结果及结论: 。
(3) 实验中采用3H-TDR的原因是: 。
30.(14分)研究人员进行了多种植物激素对豌豆植株侧芽生长影响的实验,结果见下图。

请回答:
(1) 比较曲线1.2.3.与4.可知______对侧芽的生长有抑制作用,其中起作用的主要激素是______,而且______(激素)能解除这种激素的抑制作用。在保留顶芽的情况下,除了3所采用的措施外,还可通过喷施______的化合物促进侧芽生长。
(2) 比较曲线4与5。可知赤霉素能明显促进 ______。而在完整豌豆植株的顶芽中,赤霉素产生于______组织。
(3) 分析上图,推测侧芽生长速度不同的原因是侧芽内______浓度或比例的改变。
29.(14分)白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:

根据以上信息回答下列问题:
(1)白藜芦醇的分子式是________。
(2)C→D的反应类型是_________;E→F的反应类型是________。
(3)化合物A不与FeCL3溶液发生显色反应,能与NaHCO3反应放出CO2,推测其核磁共振氢谱(1H-NMR)中显示有_______种不同化学环境的氢原子,其个数比为_______。
(4)写出A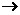 B反应的化学方程式_______
B反应的化学方程式_______
(5)写出化合物D、E的结构简式:D_______,E_______。
(6)化合物 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
①能发生银镜反应;②含苯环县苯环上只有两种不同化学环境的氢原子。
28.(15)二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
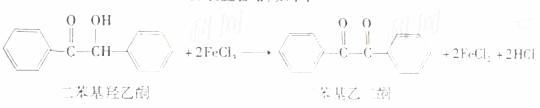
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮精产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程。

请回答以下问题:
(1) 写出装置图中下班仪器的名称:a__________.b___________
(2) 趁势过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:_________
A.缓慢冷却溶液 B.溶液深度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用_______._________等方法促进晶体析出。
(3) 抽滤所用的滤纸应略_____(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮品体转人布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_____
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始,回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是________。
 A. 15
min
B.30 min
C. 45 min
D.60 min
A. 15
min
B.30 min
C. 45 min
D.60 min

27.(14分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/mol・L-1 |
2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是 。
A.2v(NH2)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是 (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变△H O(填“>”、“=”或“<”),熵变△S O
(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O NH4HCO2+NH3・H2O
NH4HCO2+NH3・H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO2)时间的变化趋势如图所示。
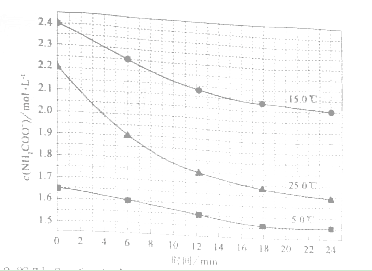
⑤计算25.0°C时,0-6min 氨基甲酸铵水解反应的平抑速率:_______。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:_____。
26. (15分)食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的,已知:


(1)某学习小组对加碘盐进行了如下实验:去一定量某加碘盐(可能含有KIO2、KI、Mg2+、Fe3+)。用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分3份,第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCI4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO,固体后,滴加淀粉试剂,溶液不变色。
① 该红色物质是 (用化学是表示);CCI4中显示紫红色的物质是 (用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3・H2O。该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: 。
(4)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A. Na2S2O2 B. AICI3 C. Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
25.(22分)如图甲所示,静电除尘装置中有一长为L、宽为b、高为d的矩形通道,其前、后面板使用绝缘材料,上、下面板使用金属材料。图乙是装置的截面图,上、下两板与电压恒定的高压直流电源相连。质量为m、电荷量为-q、分布均匀的尘埃以水平速度v0进入矩形通道,当带负电的尘埃碰到下板后其所带电荷被中和,同时被收集。通过调整两板间距d可以改变收集频率η。当d=d0时η为81%(即离下板081d0范围内的尘埃能够被收集)。
不计尘埃的重力及尘埃之间的相互作用。
(1)
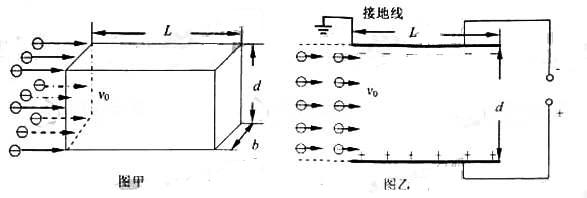 求收集效率为100%时,两板间距的最大值为dm;
求收集效率为100%时,两板间距的最大值为dm;
(2) 求收集率η与两板间距d的函数干系;
(3)
若单位体积内的尘埃数为n,求稳定工作时单位时间下板收集的尘埃质量 与两板间距d的函数关系,并绘出图线
与两板间距d的函数关系,并绘出图线
23.(16分)如图甲所示,在水平面上固定有长为L=2m、宽为d=1m的金属“U”型轨导,在“U”型导轨右侧l=0.5m范围内存在垂直纸面向里的匀强磁场,且磁感应强度随时间变化规律如图乙所示。在t=0时刻,质量为m=0.1kg的导体棒以v0=1m/s的初速度从导轨的左端开始向右运动,导体棒与导轨之间的动摩擦因数为μ=0.1,导轨与导体棒单位长度的电阻均为λ=0.1Ω/m,不计导体棒与导轨之间的接触电阻及地球磁场的影响(取g=10m/s2)。


(5)通过计算分析4s内导体棒的运动情况;
(6)计算4s内回路中电流的大小,并判断电流方向;
(7)计算4s内回路产生的焦耳热。
(3)(20分)节能混合动力车是一种可以利用汽油及所储存电能作为动力来源的汽车。有一质量m=1000kg的混合动力轿车,在平直公路上以v1=90km/h匀速行驶,发动机的输出功率为P=50kw。
当驾驶员看到前方有80km/h的限速标志时,保持发动机功率不变,立即启动利用电磁阻尼带动的发电机工作给电池充电,使轿车做减速运动,运动l=72m后,速度变为v2=72km/h。此过程中发动机功率的 用于轿车的牵引,
用于轿车的牵引, 用于供给发电机工作,发动机输送给发电机的能量最后有50%转化为电池的电能。假设轿车在上述运动过程中所受阻力保持不变。求
用于供给发电机工作,发动机输送给发电机的能量最后有50%转化为电池的电能。假设轿车在上述运动过程中所受阻力保持不变。求
(1)轿车以90km/h在平直公路上匀速行驶时,所受阻力F阻的大小;
(2)轿车从90km/h减速到72km/h过程中,获得的电能E电;
(3)轿车仅用其在上述减速过程中获得的电能E电维持72km/h匀速运动的距离L'。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com