
题目列表(包括答案和解析)
1.力和运动的关系(兼顾物理图象的应用)
 例1 质量为40kg的雪撬在倾角θ=37°的斜面上向下滑动,如图1甲所示,所受的空气阻力与速度成正比。今测得雪撬运动的v-t图象如图1乙所示,且AB是曲线的切线,B点坐标为(4,15),CD是曲线的渐近线。试求空气的阻力系数k和雪撬与斜坡间的动摩擦因数μ(g=10 m/s2)
例1 质量为40kg的雪撬在倾角θ=37°的斜面上向下滑动,如图1甲所示,所受的空气阻力与速度成正比。今测得雪撬运动的v-t图象如图1乙所示,且AB是曲线的切线,B点坐标为(4,15),CD是曲线的渐近线。试求空气的阻力系数k和雪撬与斜坡间的动摩擦因数μ(g=10 m/s2)
解答:由图象可得,A点加速度aA=2.5m/s2;最终雪橇匀速运动时最大速度vm=10m/s,
由牛顿运动定律得:mgsin37°-μmgcos37°-5 k=maA
mgsin37°-μmgcos37°-10 k=0
代入数据解得: μ=0.125 k=20N·s/m
3.突出学科内综合
以理化生各学科的主干知识为载体,采用理化生三科“拼盘”的形势,考查理科综合能力,更加符合中学的教学实际。这将会成为以后理综命题的趋势。因此,物理复习一定要突出学科内知识的综合,对学科间的综合不要费太多的精力。
二 04年理综(物理)高考题型预测
2.突出能力考查
命题指导思想:以能力测试为主导,考查考生所学相关课程基础知识、基本技能的掌握程度和综合运用所学知识分析、解决实际问题的能力。
关于能力要求:(1)理解能力(2)推理能力(3)设计和完成实验能力(4)获取知识能力(5)分析综合能力。
31、现有味甘汁多、消暑解渴、稳定遗传的绿皮(G)红瓤(R)、小籽(e)西瓜品种甲与白皮(g)黄瓤(r)、大籽(E)西瓜品种乙,三对基因自由组合。已知西瓜的染色体数目2n=22,请根据下面提供的西瓜育种流程图回答有关问题:

(1)图中①过程所用试剂为__________,通过②途径培育无籽西瓜的方法叫做_________,所结西瓜果实的基因型和表现型分别为___________、___________
(2)通过③培育无籽西瓜时所用的试剂为__________,施用的时机和部位是___________。瓜农用②生产的无籽西瓜比用③更受消费者青睐,原因是____________________________。如果选用的品种优秀,瓜农们也乐意采用③途径生产无籽西瓜,其优点是________________________________。
 (3)种子公司品种甲作母本、品种乙作父本,通过⑤途径制得杂交种F1,待其播种开花后彼此相互授粉,结出的瓜比亲本个大、味甜、品位高、这是利用了____________的原因。将此瓜所结种子(即F2)留下,来年再种的结果是产量、品质大大下降,这种现象在遗传学上称__________,这些种子胚的基因型在理论上有______________种。
(3)种子公司品种甲作母本、品种乙作父本,通过⑤途径制得杂交种F1,待其播种开花后彼此相互授粉,结出的瓜比亲本个大、味甜、品位高、这是利用了____________的原因。将此瓜所结种子(即F2)留下,来年再种的结果是产量、品质大大下降,这种现象在遗传学上称__________,这些种子胚的基因型在理论上有______________种。
(4)通过④细胞融合途径形成杂种体细胞时,要使用__________和__________两种化学物质。由该杂种细胞形成杂种植株利用了___________原理,使用了______________技术。若由杂种植株去获得单倍体植株,需使用的方法是进行____________培养。
(5)为确认上述植株是否是单倍体,应在显微镜下检查根尖分生区细胞的细胞核,辨明染色体数目。此时应该准备的试剂是_________、__________和___________,观察的最佳时期为___________,看到的染色体数目应是____条。
(6)通过⑤途径形成的F1的胚乳细胞用组织培养的方法理论上也能形成西瓜幼苗。对它的根尖镜检,应该找到________个染色体组,其中________个来自母体,__________个来自父本。
30、I.新华社2005年3月报道,广东省质量技术监督局从亨氏美味源(广州)食品有限公司(简称亨氏美味源)生产的272箱美味源金麦桂林辣椒酱中,检验出苏丹红一号成分。苏丹红一号型色素是一种人选化学制剂,全球多数国家都禁止将其用于食品生产。这种色素常用于工业方面,比如溶解剂、机油、蜡和鞋油等产品染色。科学家通过实验发现,“苏丹红一号”会导致鼠类致癌,它在人类肝细胞中也显现出可能致癌的特性。据此,回答下列问题:
(1)“苏丹红一号”致癌属于_________致癌因子
(2)苏丹红可作为生物组织染色剂,用它对大豆子叶染色、镜检,哪种成分或结构可被染色___________A多糖 B蛋白质 C油滴 核酸
(3)“苏丹红一号”能使肝脏致癌,肝炎病毒感染久治不愈,也会使病毒DNA整合到肝细胞中,引发肝癌。从变异来源看,二者的主要区别在于__________
II.2005年4月6日卫生部发布了《苏丹红危险性评估》报道中提到苏丹红是一种人工色素(工业染料)它在人体内代谢生成相应胺类。科研人员以小鼠为实验材料,用细胞培养技术对其毒性进行检测,如下图所示:
①实验小鼠为雌性,图中①为_____________分裂,甲细胞名称是___________
②若该雌鼠基因型为AaBbDD图甲1表示性染色体,则2、3、4表示_____________,与本次分裂同时产生的配子基因型为_______________
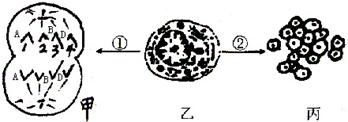
③用过程②检测有毒物质毒性的指标是_____________________,所用培养液中除葡萄糖、氨基酸外还应加入_______________________
④请完善检测苏丹红毒性的实验步骤:
主要实验步骤
第一步配制浓度(mg·L-1)分别为10、50、100、300、900一系列苏丹红溶液;
第二步,取大小相同的六只培养瓶编号为1~6号,分别加入等量相同的培养液和小鼠细胞。
第三步___________________________________________________________
第四步___________________________________________________________
结果如下表:
|
培养瓶编号 |
1 |
2 |
3 |
4 |
5 |
6 |
|
添加剂中苏丹红浓度(mg·L-1) |
水 |
10 |
50 |
100 |
300 |
900 |
|
变异细胞比例 |
0 |
0 |
1/106 |
1/106 |
2/106 |
8/106 |
结论:___________________________________________________________
29、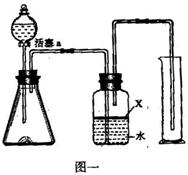 (12分)氮化铝(AIN)是一种新型的无机
(12分)氮化铝(AIN)是一种新型的无机
材料,广泛用于集成电路生产领域。
某氮化铝样品中含有碳或氧化铝杂质,现用图一
装置进行实验,使氮化铝样品与NaOH溶液反应,
根据反应所生成气体的体积来测定样品中氮化铝
的质量分数,并根据实验现象确定杂质的成分。
实验过程记录如下:
a.检查装置气密性;b.信锥形瓶中放入适量氮化
铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH
溶液,立即发生剧烈反应,生成的气体将广口瓶
中的水排入量筒中;c.反应结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算。
(1)氮化铝与NaOH溶液反应的化学方程式为:__________________。
(2)本实验中,检查装置气密性的方法是__________________________。
(3)广口瓶中的试剂X最好选用__________(填选项的标号)。
|
A、苯 |
B、酒精 |
C、植物油 |
D、四氯化碳 |
(4)广口瓶中的液体足量但没有装满(上方留
 有少量空间),实验结果测得的气体的体积
有少量空间),实验结果测得的气体的体积
将_______(填“偏大”、“偏小”或“无影
响”)。实验结束后,若观察到锥形瓶中还
有固体,则样品中含有的杂质是_________。
(5)若实验中样品的质量为mg,实验测得反应
产生气体的体积为aL(已折算成标准状况),
则样品中AIN的质量分数为__________。
(6)有人改用图二装置进行同样实验,通过测
定烧杯中硫酸的增重来确定样品中AIN的
质量分数。
你认为两种实验方案中,比较好的是用________装置进行实验(填“图一”或“图二”)。理由是________________________________________________。
28、 (22分)国家质检总局下令严禁在食品中使用的“吊白块”,化学名称为甲醛次硫酸氢钠,化学式为NaHSO2·CH2O·2H2O。违法者在食品中添加“吊白块”是为了达到漂白增色、防腐等目的,但破坏了食品的营养成分,食用后引起人体过敏、刺激肠道、食物中毒等疾患,严重者影响视力,甚至会致癌。“吊白块”可用甲醛和次硫酸氢钠(NaHSO2)反应制得。次硫酸是一种弱酸。
(22分)国家质检总局下令严禁在食品中使用的“吊白块”,化学名称为甲醛次硫酸氢钠,化学式为NaHSO2·CH2O·2H2O。违法者在食品中添加“吊白块”是为了达到漂白增色、防腐等目的,但破坏了食品的营养成分,食用后引起人体过敏、刺激肠道、食物中毒等疾患,严重者影响视力,甚至会致癌。“吊白块”可用甲醛和次硫酸氢钠(NaHSO2)反应制得。次硫酸是一种弱酸。
请回答下列问题:
(1)次硫酸氢钠的水溶液呈(填“酸性”、“中性”或“碱性”)________,其原因是(用离子方程式表示)_________________________。
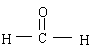 (2)同温度均为0.1mol·L-1的NaHSO2和H2SO2溶液中,由水电离出的C(H+)是:NaHSO2溶液_________H2SO2溶液(填>、<、=),理由是:_______________。
(2)同温度均为0.1mol·L-1的NaHSO2和H2SO2溶液中,由水电离出的C(H+)是:NaHSO2溶液_________H2SO2溶液(填>、<、=),理由是:_______________。
(3)甲醛( )是一种重要的化工原料,纯净的甲醛在催化剂作用下发生聚合反应生成的聚甲醛是一种优良的工程塑料,聚甲醛结构结构简式为_______________________。


(4)已知①
+CO+H2
 ②以甲醛为原料的有关反应如下:
②以甲醛为原料的有关反应如下:
其中A可被新制的Cu(OH)2氧化;亦可发生酯化反应;B的相对分子质量是甲醛的3倍。则:
①A分子中含有的官能团为(填名称):__________________。
A的同分异构体有(填结构简式):________________、_______________。
②A与新制的Cu(OH)2反应的化学方程式为:__________________。
③B可以被酸性KMnO4溶液氧化,请在下面方框内填上B的结构简式,完成并配平反应的化学方程式:
 ______
+_____Mn
______
+_____Mn +______H+-CO2+↑______Mn2++______
+______H+-CO2+↑______Mn2++______
④B和A的还原产物在一定条件下可以反应生成高聚物,其化学方程式为:__________。
27、(10分)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O之外还有H2O2;,碳元素的氢化物除CH4外还有C2H6等,与之相似的氮元素的氢化物除NH3外还有N2H4等。
(1)碳原子之间可结合链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以N-N键形式连接,并形成氢化物,则该系列氢化物的通式为_______________.
(2)该系列中N2H4是“神六”发射时所用的液态燃料,液态N2O4作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知4gN2H4在上述反应中生成H2O(g)并放出71KJ的热量,写出热化学方程式__________________
(3)该系列中NH3对农业、化学和国防工业具有重要的意义。其合成原理是
N2(g) +3H2(g)
 2NH3(g);ΔH=-92KJ/mol。
2NH3(g);ΔH=-92KJ/mol。
Ⅰ.在一定的温度下,将1.5mol N2 6molH2通入到一个固定容积的密闭容器中,当反应达到平衡时。容器内的气体压强为起始的80%,此时反应放出的热量为____________。
Ⅱ.保持温度不变,在相同的容器中,起始的物质的量改为amolN2、bmolH2和cmolNH3,使平衡时的NH3的物质的量的分数为25%,则:
①达到平衡时,Ⅰ 与Ⅱ放出的热量_________(填字母代号)
|
A、一定相等 |
B、前者一定小于后者 |
|
C、前者等于或小于后者 |
D、前者等于或大于后者 |
②欲使该反应正向进行,a的取值范围是____________。
26、(16分) 图一每个方框中的字母表示有关的一种反应物或生成物,已知Y物质在加热的条件下能分解成等物质的量的三种气体,且D在常温下为无色液体,反应②是工业上制备Z的主要反应之一。
|

根据以上内容判断并回答问题:
(1)写出X、Y的化学式X__________,Y___________。
(2)写出E电子式____________, E是_____________分子(填极性分子或非极性分子)
(3)写出反应①的离子方程式_______________________________。
(4)写出反应②的化学方程式_______________________________。
(5)写出C和Na2O2反应的可能的化学方程式_________________________,
并设计实验证明你的判断_________________________________________
_______________________________________________________________(要求写出方法、操作、现象和结论)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com