
题目列表(包括答案和解析)
7.分子式为C4H9Cl的同分异构体有 ( )
A.1种 B.2种 C.3种 D.4种
6.下列有关溶液性质的叙述,正确的是 ( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2g KCl,此时KCl 饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
5. 在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g)
在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g)
达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,
NO2的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断
4.把Ba(OH)2溶液滴入明矾溶液中,使SO 全部转化成BaSO4沉淀,此时铝元素的主要存
全部转化成BaSO4沉淀,此时铝元素的主要存
在形式是 ( )
A.Al3+ B.Al(OH)3 C.AlO D.Al3+和Al(OH)3
D.Al3+和Al(OH)3
3.pH相同的盐酸和醋酸两种溶液中,它们的 ( )
A.H+的物质的量相同 B.物质的量浓度相同
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
2.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关
于NO的说法不正确的是 ( )
A.NO分子中有极性共价键 B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
1.下列各组物质中,互为同位素的是 ( )
A.重氢、超重氢 B.氧、臭氧
C.红磷、白磷 D.乙酸、丙酸
26.(10分)石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
CH2=CH2+Cl2 →CH2CI-CH2C1…………………①
CH2CI-CH2C1→CH2=CHCl+HCl………………②
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率= ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2=CH2+4HCl+02→2 CH2CI-CH2C1+2H20………-③
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
25.(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
24.(10分)环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
 (也可表示为:
(也可表示为: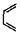 +║→
+║→ )
)
丁二烯 乙烯 环已烯
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化: 
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:

请按要求填空:
(1)A的结构简式是 ;B的结构简式是 。
(2)写出下列反应的化学方程式和反应类型:
反应④ ,反应类型 反应⑤ ,
反应类型 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com