
题目列表(包括答案和解析)
1.连续分裂的动物体细胞的生长即体积增大,发生在细胞周期的 ( )
A.分裂间期 B.分裂前期 C.分裂中期 D.分裂后期
 2.右图表示在适宜的温度、水分和CO2条件下,两种植物光合作用强度的变化情况。下列说法错误的是 ( )
2.右图表示在适宜的温度、水分和CO2条件下,两种植物光合作用强度的变化情况。下列说法错误的是 ( )
A.当光照强度增加到一定程度时,光合作用强度不再增加,即达到饱和
B.C3植物比C4植物光合作用强度更容易达到饱和
C.C4植物比C3植物光能利用率高
D.水稻是阴生植物,玉米是阳生植物
31. (14分)科研人员对低磷环境对于水稻生长的影响进行研究,得到的结果如图所示。

(1)该实验所需的材料用具除四个不同品种水稻的种子若干粒、次氯酸钠消毒液、蒸馏水、八个盛有蛭石的容器、低磷营养液、正常浓度磷营养液和清水外,还应有__________________。
(2)将实验步骤补充完整:
①将水稻种子经次氯酸钠溶液消毒后,用蒸馏水清洗2遍,37℃催芽。
②待根长至1cm左右时,将四个品种幼苗分别平均分成甲、乙两组,移至八个盛有蛭石的容器中;编号作标记。
③_______________________________________________________________。
④_______________________________________________________________。
⑤____________________________________________________________。
(3)从图中实验结果可知,低磷环境对于四个品种水稻的根系生长均有_______作用,对于不同品种的作用有差异,说明水稻根系生长状况是由_____________________决定的。
(4)低磷对于四个品种的地上部分生长有抑制作用,这是因为磷在植物体内参与_______________________________________________________________等生理过程。
30. (16分)骡子是马(2N=64)和驴(2N=62)杂交所得,母马与公驴的后代为马骡,母驴和公马的后代为驴骡。
(1)马骡和驴骡体细胞中染色体数是否相同?应为多少?__________________。驴骡的Y染色体上基因控制的性状应与_________(马/驴)一致。
(2)马骡和驴骡体细胞中线粒体DNA是否相同?为什么?__________________
____________________________________________________________________。线粒体中DNA与核DNA在存在形式上的主要区别是___________________________。
(3)骡子的细胞可以进行正常的_________分裂,一般不能进行正常的_________分裂。因
为_________时会发生紊乱,一般不能形成可育的配子,这反映了在马和驴这两个物种间存在着_________隔离。
29. (18分)光合细菌,属红螺菌科,是能以光作为能源、以二氧化碳或有机物作为碳源进行繁殖的微生物,广泛分布于湖泊、海洋、土壤中。将红螺菌科的A、B、C、D四种菌株分别接种到三角瓶培养液中,于不同光照下培养,其生长曲线如图1~图3。

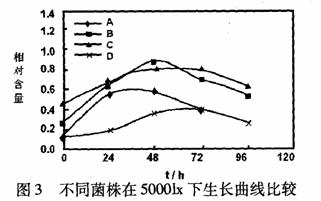
(l)由图1~图3看出:①________菌株在不同光照强度下均表现出较高的生长速率;
___________菌株在三种光照强度下生长均欠佳,________菌株在1000lx、30001x光照下生长
较好,而在50001x光照下生长很差。②光合细菌生长繁殖的较适宜光照强度为___________1x,在该光照强度下,菌体对数生长期较长,细胞数量达到较高的数值。
(2)红螺菌和人的细胞在结构上的最主要区别是______________________;二者都能合成由104个氨基酸组成的细胞色素C,则红螺菌控制合成细胞色素C的基因中编码区的脱氧核苷酸数目与人的相比应________(多/少)于人类。
(3)红螺菌可以作为鱼虾等水产动物的饵料提高产量,是因为其细胞中含有
_________________________________________营养物质(答出三种即可)。
(4)定期向养鱼虾的池塘中泼洒的红螺菌,能够抑制其它病菌生长繁殖,起到防治疾病的作用。这利用了生态因素中的_________关系。
(5)红螺菌可以防止水体富营养化。若以实验验证这一假设,可以以_________的值作为观察测量的对象。
28. (l2分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:

(1)A的化学式为___________________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子
_________________mol。
(3)写出D与铝单质反应的化学方程式______________________。
(4)反应②是可逆反应,在2L的密闭容器中投入4molC和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是___________(填写序号字母)。
A. 工业制取F时,C和X生成E的反应是在吸收塔进行
B. 这10分钟内,X的平均反应速率是0.lmol/(L·min)
C. 当C和X的消耗速率比为2:1时,标志着反应达到平衡
D. 平衡时C的转化率是50%
E. 在工业生产中可以通过增加X浓度来提高C的转化率
F. 工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
_______________________________________________________。
(6)将5mL0.02mol/L的F溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是___________。
27. (14分)有A、B、C、D、E五种短周期元素,原子序数依次增大。A元素原子内无中子;B、C、D同周期;B元素原子最外层电子数是次外层的2倍;D是地壳中含量最多的元素;E与A同主族。回答下列问题:
(1)画出E元素的离子结构示意图______________。
(2)D、E形成的一种化合物甲能与B、D形成的一种化合物乙反应,生成D的单质。写出甲与乙反应的化学方程式____________________________________。
(3)采用石墨为电极,电解A、D、E三种元素所形成的一种化合物,其阳极电极反应为
_____________________________________________。
(4)A、C能形成一种常见气体丙,其分子为___________分子(填“极性”或“非极性”);丙的电子式为______________________;实验室制取气体丙的化学方程式为_________________
___________________________________。
(5)在一定条件下,lmol气体丙还可与D的单质反应,生成水蒸气和另一种气体,同时转移 个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
______________________________________________________。
26. (18分)现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)___________________________________________
______________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为__________________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
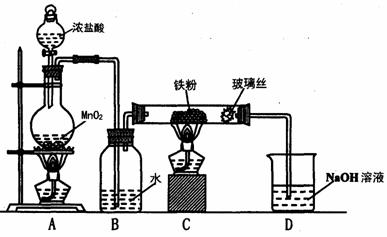
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
25. (16分)咖啡酸( )也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
)也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是____________________。
(2)咖啡酸不具有以下哪些化学性质__________(填写序号字母)。
A. 有浓硫酸、加热条件下能发生消去反应
B. 能与FeCl3溶液发生显色反应
C. 能发生银镜反应
D. 一定条件下能发生酯化反应
(3)1mol咖啡酸跟浓溴水反应时最多消耗______molBr2,反应类型有
____________________________________________________________。
(4)写出咖啡酸一定条件下发生加聚反应的方程式
____________________________________________________________。
写出咖啡酸与NaHCO3溶液反应的方程式
____________________________________________________________。
(5)写出符合下列条件的有机物A的结构简式
有机物A的分子式为C9H10O2;分子中有一个甲基;A能发生水解反应;在溶液中1molA能与2molNaOH反应
____________________________________________________________。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成yg H2O和mL CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式____________________。
24. (20分)如图甲所示,光滑且足够长的平行金属导轨MN、PQ固定在同一水平面上,两导轨间距L=0.3m。导轨电阻忽略不计,其间连接有固定电阻R=0.4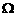 。导轨上停放一质量m=0.1kg、电阻r=0.2
。导轨上停放一质量m=0.1kg、电阻r=0.2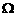 的金属杆ab,整个装置处于磁感应强度B=0.5T的匀强磁场中,磁场方向竖直向下。利用一外力F沿水平方向拉金属杆ab,使之由静止开始运动,电压传感器可将R两端的电压U即时采集并输入电脑,获得电压U随时间t变化的关系如图乙所示。
的金属杆ab,整个装置处于磁感应强度B=0.5T的匀强磁场中,磁场方向竖直向下。利用一外力F沿水平方向拉金属杆ab,使之由静止开始运动,电压传感器可将R两端的电压U即时采集并输入电脑,获得电压U随时间t变化的关系如图乙所示。
(l)试证明金属杆做匀加速直线运动,并计算加速度的大小;
(2)求第2s末外力F的瞬时功率;
(3)如果水平外力从静止开始拉动杆2s所做的功为0.3J,求回路中定值电阻R上产生的焦耳热是多少。

23. (l8分)如图所示,BC是半径为R的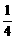 圆弧形的光滑且绝缘的轨道,位于竖直平面内, 其下端与水平绝缘轨道平滑连接,整个轨道处在水平向左的匀强电场中,电场强度为 E. 现有一质量为m、带正电q的小滑块(可视为质点),从C点由静止释放,滑到水平轨道上的A点时速度减为零。若已知滑块与水平轨道间的动摩擦因数为
圆弧形的光滑且绝缘的轨道,位于竖直平面内, 其下端与水平绝缘轨道平滑连接,整个轨道处在水平向左的匀强电场中,电场强度为 E. 现有一质量为m、带正电q的小滑块(可视为质点),从C点由静止释放,滑到水平轨道上的A点时速度减为零。若已知滑块与水平轨道间的动摩擦因数为 ,求:
,求:
(1)滑块通过B点时的速度大小;
(2)滑块经过圆弧轨道的B点时,所受轨道支持力的大小;
(3)水平轨道上A、B两点之间的距离。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com