
题目列表(包括答案和解析)
1.落实基础知识,本单元内容难点较少,基本概念较多。在复习时要注意对概念的理解和运用,如:
(1)物质的性质和变化的判断。物理性质和化学性质的区别在于是否需要通过化学变化表现出来;判断物理变化和化学变化的依据是看是否有新的物质生成。
(2)化合反应和分解反应的判断。化合反应可以概括为“多变一”,分解反应可以概括为“一变多”。
4.几组重要的概念
(1)纯净物和混合物:纯净物是由一种物质组成,如氮气、氧气、二氧化碳、水等;混合物是由两种或多种物质组成的,如空气、矿泉水等。注意混合物中的各种纯净物各自保持自己的化学性质。
(2)化合反应和分解反应:由两种或两种以上的物质生成一种物质的反应,叫做化合反应;由一种物质生成两种或两种以上物质的反应,叫做分解反应。它们的共同点是都属于化学变化。
(3)催化剂与催化作用:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有改变的物质叫做催化剂(又叫触媒);催化剂在化学反应中起的作用叫催化作用。在理解催化剂时要记住“一变”和“二不变”的涵义,催化剂改变的是反应速率,在反应过程中有的也能发生化学反应。
(4)氧化反应和缓慢氧化:物质跟氧发生的反应,叫做氧化反应。这里的“氧”既包括游离态的氧元素,又包括化合态的氧元素;缓慢氧化是一种不易察觉的氧化反应。它们的共同点是都属于氧化反应。
3.实验室制取氧气
(1)反应物及反应条件:氯酸钾和二氧化锰,加热;高锰酸钾,加热;双氧水和二氧化锰,常温。
(2)反应原理:
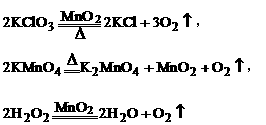
(3)反应装置:若用氯酸钾和二氧化锰的混合物或高锰酸钾制取氧气,采用固体加热型;若用双氧水和二氧化锰的混合物制取氧气采用固液不需加热型。
(4)收集与放置:因为氧气不易溶于水,可用排水法收集;又因为氧气的密度比空气大,可用向上排空气法收集。关于集气瓶的放置要注意两点:一是要用毛玻璃片盖着,防止气体散逸;二是“正放”或“倒放”,这要看该气体与空气比谁轻谁重,若同体积的气体比空气重,则正放,若比空气轻,则倒放。如氧气的正确放置方法是:用毛玻璃片盖着正放在桌上。
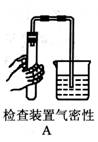
(5)实验步骤:检查装置的气密性;装药品;固定装置;加热;收集;拆导气管;熄灭酒精灯。这里需要注意的有两个问题:一是为什么开始加热时,不能立即收集,而要等大量气泡连续、均匀放出时收集?二是实验结束时,为什么要先拆导气管,后移酒精灯(读者可自行整理答案)?
(6)检验:“检验”是指利用被检物质的某种“特殊性质”形成的某种“特殊现象”,从而确定该物质的过程。如利用氧气的助燃性,可使带火星的木条复燃,可证明是氧气(验满时放于瓶口处)。
2.氧气
(1)氧气的物理性质:包括氧气的色、态、味、密度、溶解性、熔沸点等。
(2)氧气的化学性质:
|
反应物 |
反应现象 |
|
|
在空气中 |
在氧气中 |
|
|
木炭与氧气 |
持续红热,无烟,无焰 |
剧烈燃烧,发出白光,放出热量,生成一种无色无味气体 |
|
硫磺与氧气 |
持续燃烧放热,有隐约可见的淡蓝色火焰,无烟 |
有明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体 |
|
红磷与氧气 |
黄白色火焰,伴有放热和大量白烟 |
发出耀眼的白光,放出热量,生成大量白烟 |
|
铁丝与氧气 |
灼成红热,离火后变冷 |
用木条引燃后,能持续剧烈燃烧,火星四射,放热,将铁丝熔成小球,同时生成黑色固体 |
|
镁条与氧气 |
持续燃烧,产生耀眼的强光,放出大量热,生成一种白色固体(伴有白烟) |
比在空气中燃烧更加强烈 |
|
蜡烛与氧气 |
黄白色光亮火焰,火焰分层,放出热量,稍有黑烟 |
火焰十分明亮,分层,放出热量,瓶壁有雾珠,还有无色气体生成,能使澄清的石灰水变浑浊 |
氧气是一种化学性质比较活泼的气体,在点燃或加热等条件下,能与许多物质(如金属、非金属等)发生化学反应。现将木炭、硫、磷、镁、铁等与氧气反应的现象比较如上表所示。
1.空气
(1)空气的组成(按体积分数):氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他气体和杂质0.03%。空气是以氮气和氧气为主的一种复杂混合物,其成分具有相对的稳定性。“其他气体”主要是指“硫的氧化物”、“氮的氧化物”及水蒸气等,“杂质”主要指“灰尘”等。
(2)探究空气成分的实验:测定空气的原理及现象的分析。如氧气供呼吸、CO2能与澄清石灰水反应生成难溶的CaCO3、水蒸气遇冷会凝聚成小液滴、装置的气密性是否完好、红磷量是否充足(过量)、能否尽可能地将装置中氧气耗尽、红磷燃烧后打开止水夹时装置内温度是否降至室温。
(3)空气的污染与防治:排放到大气里造成污染的有害物质主要可以分为粉尘和有害气体类。从世界范围来看,排放到空气中的污染物较多的是二氧化硫、一氧化碳、二氧化氮等。造成空气污染的原因主要是矿物燃料(煤和石油)的燃烧和工厂的废气。因此,防止空气的污染必须从这两个方面入手。
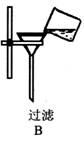
3.下图所示的实验操作与方法正确的是( )
第二单元:我们周围的空气
2.用托盘天平称量干燥的固体药品时,在两个托盘上各放一张相同质量的纸片,其理由是 。
1.现有如下仪器:a.量筒b.玻璃棒c.药匙d.托盘天平e.蒸发皿f.胶头滴管,请回答:
(1)称量固体药品的是 。
(2)取用固体药品的是 。
(3)量取液体体积的是 。
(4)可用于搅拌液体的是 。
(5)用于给液体加热的是 。
(6)用于吸取和滴加少量液体的是 。
7.化学实验基本操作在化学学习和研究中具有重要作用。我们在进行化学实验时,若遇到下列情况,应如何操作。
(1)洗涤试剂瓶内壁附有的碳酸钙 。
(2)过滤操作后得到的滤液仍然浑浊 。
(3)连接玻璃管和胶皮管,玻璃管不容易插入胶皮管内 。
挑战题
6.下列试剂中:①氧化铜粉末②石灰石块③试剂瓶中的盐酸
应该用药匙取用的是 ,应该用镊子夹取的是 ,应该用滴管吸取的是 。(填试剂序号即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com