
题目列表(包括答案和解析)
30.I.(10分) (1)增强 抑制性腺的活动,严重者会导致性腺的萎缩 注:答案必须是针对性腺的影响。 (2)升高 产热 呆小症 (3)协同 (4)②耗氧量 等量的蒸馏水 ③A:甲、乙组耗氧相近 B:甲组耗氧量大于乙组
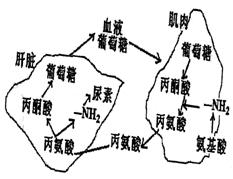 Ⅱ.(10分)民以食为天。了解食物的特性,科学配置一日三餐,对于提高生活质量,增进身体健康是非常重要的。蛋白质是人体必需的营养物质之一,人体每天必须摄入一定量的蛋白质。
Ⅱ.(10分)民以食为天。了解食物的特性,科学配置一日三餐,对于提高生活质量,增进身体健康是非常重要的。蛋白质是人体必需的营养物质之一,人体每天必须摄入一定量的蛋白质。
(1)食物中的蛋白质在消化道内被分解成
后才能被吸收。下图所示为空腹时,丙氨酸由肌肉进入肝脏,肝脏内有葡萄糖的产生主要是因为发生了 作用。由图可知,丙氨酸是 氨基酸。
(2)丙氨酸进入肝脏,如果在肝脏内氨基转换反应速度减慢,可以通过测定血清中
(酶)的含量来判断肝细胞是否受损。
(3)牛奶中蛋白质的含量高,营养价值丰富。但空腹喝牛奶,不能充分利用其营养价值。请你利用以下提供的实验材料和用具设计一个实验,验证空腹喝牛奶时不能充分利用其营养价值。提示:实验动物--20只小白鼠 饲料--含有15N的牛奶;糖类和含有15N的牛奶 工具--同位素15N含量检测仪(在无机械损伤的情况下检测)
①实验原理:__________________________________________;
②实验步骤:
第一步:______________________________________________;
第二步:______________________________________________;
第三步:______________________________________________;
第四步:经过几小时后检测小鼠尿液中15N的含量
③实验结果预期:______________________________________;
④实验结果分析:______________________________________。
30. I.(10分) 图14示哺乳动物(或人体)激素分泌的调节过程请据图回答下列问题:
I.(10分) 图14示哺乳动物(或人体)激素分泌的调节过程请据图回答下列问题:
(1)若图中所示腺体为睾丸,睾丸分泌的睾丸酮(雄性激素)具有增强蛋白质合成、促进肌肉发育和骨骼生长,使体内贮存的脂肪减少等作用。个别男性运动员长期用睾丸酮,则④⑤所示作用会 。可以预测,对其性腺造成的危害是 。
(2)若图中所示腺体为甲状腺,大脑感觉到寒冷刺激,则通过如图①②所示的调节过程,血液中的甲状腺激素浓度 ;通过③过程,机体的 增加,抵御了寒冷,适应了环境。甲状腺激素是含碘的氨基酸的衍生物。我国政府在碘贫乏地区强制推广加碘食盐,有效地预防了 患儿的出生。
(3)甲状腺激素和生长激素在调节动物的生长发育过程中表现为 作用。
(4)为了验证甲状腺激素具有促进新陈代谢的生理作用,请你根据给出的实验材料和用具,完善实验步骤,并预测实验结果。
①材料和用具:日龄相同体重相近的雄性成年大白鼠若干只,甲状腺激素溶液,蒸馏水,灌胃器,耗氧量测定装置等。
②方法与步骤:
A.将实验鼠随机分为数量相等的甲、乙两组,并分别用给出的仪器,测定并记录它们 。
B.每天用灌胃给予甲组鼠灌喂甲状腺激素溶液,给予乙组鼠灌喂 ,饲养一定时间.测定与记录结果
③结果预测:
A步骤的测定结果是: 。
B步骤的测定结果是: 。
29.(1)X的可能结构简式:

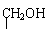
Ⅰ:HOOC-CH-CH2-COOH Ⅱ:HOOC-CH-COOH

Ⅲ:HOOC-C-COOH(各1分)

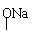
(2)2HOOC-CH-CH2-COOH+6Na 2NaOOC-CH-CH2-COONa+3H2↑
2NaOOC-CH-CH2-COONa+3H2↑

或2HOOC-CH-COOH+6Na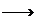 2NaOOC-CH-COONa+3H2↑
2NaOOC-CH-COONa+3H2↑

或2HOOC-C-COOH+6Na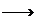 2NaOOC-C-COONa+3H2↑(任写一种可得3分)
2NaOOC-C-COONa+3H2↑(任写一种可得3分)
(3)B、D、F (3分) (4)a(1分);b、c(2分)

(5)HOOC-C-CH2-COOH HOOC-CH-COOH (各1分)
29.(14分)某有机物X(分子式为C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。为确定该有机物的结构式特进行如下实验(见下表),请根据题目要求填写下列空格。
|
实验步骤 |
实验内容 |
|
① |
X与足量的金属钠反应产生氢气。 |
|
② |
X与醇或羧酸在浓硫酸加热条件下均能生成有水果香味的有机物。 |
|
③ |
在一定条件下X的分子内脱水产物(不是环状化合物)可与溴水发生加成反应 |
|
④ |
33.5 g X与100 mL的5 mol·L-1氢氧化钠溶液恰好完全中和。 |
(1)X的可能结构简式Ⅰ:_____________________,Ⅱ:_______________________,
Ⅲ:____________________________。
(2)写出X发生①反应的化学方程式(任写一个)______________________________。
(3)在一定条件下有机物X可发生化学反应的类型有(填序号)_____________。
A.水解反应 B.取代反应 C.加成反应
D.消去反应 E.加聚反应 F.中和反应
(4)下列物质与X互为同系物的是(填序号)________,与X互为同分异构体的是(填序号)__________。
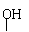


a. HOOC-CH-CH2-CH2-CH2-COOH b. HOOC-CH-CH-CHO

c. HOOC-CH-COOCH3 d. H3COOC-COOCH3
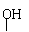



e. H3COOC-CH-(CH2)4-COOCH3 f. H2C--CH-CH-COOH
(5)写出X与O2在铜作催化剂加热的条件下发生反应所得到的所有可能产物的结构简式为:_____________________________________。
28.(20分)
(1)C、B、D、E、A、F(方程式各3分,其它每空2分)
(2)除去空气中还原性、酸性气体;除去水蒸气
(3)I2+SO2+2H2O 2I-+SO42-+4H+
(4)溶液恰好由无色变为蓝色,且半分钟不褪色。
(5)固体与气体反应,固体难反应完(或固体燃烧不充分);溶于水的SO2部分被氧化;生成的SO2未完全溶解而逸出等
(6)Ⅰ 32% (3分)
Ⅱ SO3(g)+H2O(1) H2SO4(1);△H=-130.3KJ/mol(4分)
28.(20分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:

实验时有如下操作:
A.将试管中样品加热到800℃~850℃
B.称取研细的黄铁矿样品
C.连接好全部仪器,并检查其气密性
D.将样品小心放硬质试管中部
E.以均匀的速度不断鼓入空气
F.用标准碘溶液滴定含淀粉的SO2水溶液
(1)正确的实验步骤的次序是(以A、B……的序号表示) 。
(2)装置①的作用是 ;
装置②的作用是 ;
(3)I2跟SO2水溶液反应的离子方程式为 ;
(4)根据 现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数会偏低,其原因可能是
(只需举出一种可能)
(6)完成下列计算
Ⅰ.若取6g样品在空气中充分灼烧,将吸收了SO2气体的淀粉溶液用0.1mol/L的标准碘溶液滴定,完全反应消耗溶液体积600mL,则样品中硫元素的质量分数为(假设杂质不参加反应) 。
Ⅱ.若灼烧6g上述FeS2产生的SO2全部转化为SO3气体,产生的SO3气体与水全部化合生成H2SO4,放出7.818kJ热量,写出SO3气体转化为H2SO4的热化学方程式
。
27.(11分)
(1)Si3N4、SiC14;
(2)Si3N4+3O2=3SiO2+2N2;
(3)+4,-3(2分)原子晶体(方程式各3分,其它每空2分)
27.(11分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。这类材料中研究较多的是化合物G。
(1)化合物G的相对分子质量为140,G中含硅元素,其质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:G和E的化学式分别为 、 。
(2)粉末状G能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业上生产玻璃的主要原料。请写出化合物G与氧气反应的化学方程式
。
(3)常压下在G中添加氧化铝,经高温烧结可制制成一种高强度、超硬义、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性。推测:赛伦中以下元素的化合价:Si Y ,塞伦的晶体类型
。
26. (1)N(1分)
(1)N(1分)
(2) (1分)

 (3)小于(1分);NH4++H2O
NH3.H2O+H+ (2分)
(3)小于(1分);NH4++H2O
NH3.H2O+H+ (2分)
(4)低(1分); (2分)
(2分)
(5)ab(4分)
26.(12分)X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水。
(1)Y的元素符号是____________。
(2)XW的电子式是____________。
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示)_________________________。
(4)Z元素氢化物的沸点比H2O_______(填“低”或“高”)。Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式_____________________。
(5)已知X单质和Y单质反应生成YX3是可逆反应,△H<0。将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_______。
a. 达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b. 反应过程中,Y单质的体积分数始终为50%
c. 达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d. 达到化学平衡的过程中气体平均相对分子质量减小
e. 达到化学平衡后,升高温度,YX3的体积分数增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com