
题目列表(包括答案和解析)
24.(19分)在纳米技术中需要移动或修补原子,必须使在不停地做热运动(速率约几百米每秒)的原子几乎静止下来且能在一个小的空间区域内停留一段时间,为此已发明了“激光致冷”技术,若把原子和入射光子分别类比为一辆小车和一个小球,则“激光致冷”与下述的模型很类似。
一辆质量为m的小车(一侧固定一轻弹簧),如图所示,以速度v0水平向右运动,一动量大小为P,质量可以忽略的小球水平向左射入小车并压缩弹簧至最短,接着被锁定一定时间Δt,再解除锁定使小球以大小相同的动量P水平向右弹出,紧接着不断重复上述过程,最终小车将停下来。设地面和车厢均为光滑,除锁定时间Δt外,不计小球在小车上运动和弹簧压缩、伸长的时间,求:
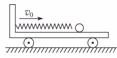
(1)小球第一次入射后再弹出时,小车的速度的大小和这一过程中小车动能的减少量。
(2)从小球第一次入射开始到小车停止运动所经历的时间。
答案:(1)设发生第一次作用后小车的速度为v1,由动量守恒定律,有mv0-P=P+mv1,(2分)所以解得:v1=v0- ,(2分)动能的减少量:ΔEk=
,(2分)动能的减少量:ΔEk= m(v02-v12)=2Pv0-
m(v02-v12)=2Pv0-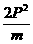 。(4分)
。(4分)
(2)设发生第二次作用后小车的速度为v2,由动量守恒定律,有mv1-P=P+mv2,所以得:v2=v1- =v0-2
=v0-2 ,(4分)所以发生n次作用后小车的速度vn=v0-n
,(4分)所以发生n次作用后小车的速度vn=v0-n ,(2分)当vn=0时,得到n=m
,(2分)当vn=0时,得到n=m ,(2分)所以小车共运动的时间t=nΔT=
,(2分)所以小车共运动的时间t=nΔT=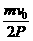 PΔt。(3分)
PΔt。(3分)
23.(16分)如图所示,在倾角θ=37°的足够长的固定的斜面底端有一质量m=1.0 kg的物体,物体与斜面间动摩擦因数μ=0.25。现用轻细绳将物体由静止沿斜面向上拉动,拉力F=10.0 N,方向平行斜面向上。经时间t=4.0 s绳子突然断了。求:

(1)绳断时物体的速度大小。
(2)从绳子断了开始到物体再返回到斜面底端的运动时间。(sin37°=0.60,cos37°=0.80,g=10 m/s2)
(1)物体受拉力向上运动过程中,受拉力F、重力mg和摩擦力f,设物体向上运动的加速度为a1,根据牛顿第二定律有:F-mgsinθ-f=ma1,(2分)又由:因f=μN,N=mgcosθ,代入数据解得:a1=2.0 m/s2。(2分)所以t=4.0 s时物体的速度大小为v1=a1t=8.0 m/s。(2分)
(2)绳断时物体距斜面底端的位移s1= a1t2=16 m。(2分)绳断后物体沿斜面上做匀减速直线运动,设运动的加速度大小为a2,则根据牛顿第二定律,对物体沿斜面向上运动的过程有:mgsinθ+μmgcosθ=ma2,代入数据解得:a2=8.0 m/s2。物体做减速运动的时间t2=v1/a2=1.0
s,(2分)减速运动的位移s2=v1t2/2=4.0 m,(2分)此后物体将沿斜面匀加速下滑,设物体下滑的加速度为a3,根据牛顿第二定律对物体加速下滑的过程有:mgsinθ-μmgcosθ=ma3,代入数据解得a3=4.0 m/s2。设物体由最高点到斜面底端的时间为t3,所以物体向下匀加速运动的位移s1+s2=
a1t2=16 m。(2分)绳断后物体沿斜面上做匀减速直线运动,设运动的加速度大小为a2,则根据牛顿第二定律,对物体沿斜面向上运动的过程有:mgsinθ+μmgcosθ=ma2,代入数据解得:a2=8.0 m/s2。物体做减速运动的时间t2=v1/a2=1.0
s,(2分)减速运动的位移s2=v1t2/2=4.0 m,(2分)此后物体将沿斜面匀加速下滑,设物体下滑的加速度为a3,根据牛顿第二定律对物体加速下滑的过程有:mgsinθ-μmgcosθ=ma3,代入数据解得a3=4.0 m/s2。设物体由最高点到斜面底端的时间为t3,所以物体向下匀加速运动的位移s1+s2= a3t32,解得t3=10 s=3.2 s,(2分)所以物体返回到斜面底端的时间为t总=t2+t3=4.2
s。(2分)
a3t32,解得t3=10 s=3.2 s,(2分)所以物体返回到斜面底端的时间为t总=t2+t3=4.2
s。(2分)
22.(17分)如图所示是“用伏安法测量电阻”的实验电路图,只是电压表未接入电路中,如图是相应的实验器材,其中待测量的未知电阻Rx阻值约为1 kΩ,电流表量程20 mA,内阻小于1 Ω,电压表量程15 V,内阻约为1.5 kΩ,电源输出电压约为12 V,滑动变阻器甲最大阻值为200 Ω,乙的最大阻值为20 Ω。

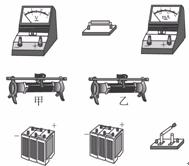
(1)在图中的电路图把电压表连接到正确的位置。
(2)根据图中的电路图把图中实物连成实验电路。
答案:(1)当Rx=1 kΩ电阻值很大,采用内接法。(8分)

(2)实物图如下:(9分)

31.(22分)某化工厂的污水池中,含有一种有害的、难于降解的有机化合物A。研究人员用化合物A、磷酸盐、镁盐以及微量元素配制的培养基,成功地筛选到能高效降解化合物A的细菌(目的菌),实验的主要步骤如图所示。请分析回答问题:
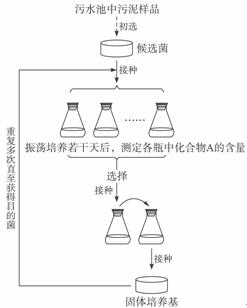
(1)培养基中加入化合物A的目的是筛选____________,这种培养基属于____________培养基。
(2)“目的菌”生长所需的氮源和碳源是来自培养基中的____________,实验需要振荡培养,由此推测“目的菌”的代谢类型是____________。
(3)培养若干天后,应选择培养瓶中化合物A含量____________的培养液,接入新的培养液中连续培养,使“目的菌”的数量____________。
(4)转为固体培养时,常采用____________的方法接种,获得单菌落后继续筛选。
(5)若研究“目的菌”的生长规律,将单个菌落进行液体培养,可采用____________的方法进行计数,以时间为横坐标,以____________为纵坐标,绘制生长曲线,该生长曲线被分为四个时期,其中菌体的特点是代谢旺盛,____________和____________比较稳定,因此常作为生产用的菌种和科研材料。
(6)实验结束后,使用过的培养基应该进行____________处理后,才能倒掉。
答案:(1)目的菌(1分) 选择(1分)
(2)化合物A(1分) 异养需氧型(1分)
(3)减少(2分) 增加(2分)
(4)划线(2分)
(5)定期取样(2分) 细菌数目的对数(2分) 个体的形态(2分) 生理特性(2分)
(6)灭菌(2分)
解析:分离、筛选微生物一般用选择培养基,而得到某种微生物后,要让其大量繁殖,必须根据其代谢特点培养,一般可采用连续培养法。微生物的生长规律分为四个时期:调整期、对数期、稳定期、衰亡期。
30.(20分)下图(一)为某夫妇含有AaBb两对等位基因的一个体细胞示意图,图(二)为某细胞分裂过程中DNA含量变化曲线图,图(三)为该妇女在一次生殖过程中生出男孩甲和女孩乙的示意图,请据图完成下列问题:

(1)图(一)中不能自由组合的基因是( )
A.A和a B.A和B C.a和b D.a和B
(2)图(一)中符合基因的分离规律的基因对是( )
A.A和b B.B和b C.a和b D.A和B
(3)与图(一)所示的基因组成相同的生物分别与以下基因型的生物相交配,后代表现型比分别为:
①与基因型为AaBb的生物相交________________。
②与基因型为AaBB的生物相交________________。
③与基因型为aabb的生物相交________________。
④与基因型为aaBb的生物相交________________。
A.9∶3∶3∶1 B.3∶1
C.1∶1∶1∶1 D.3∶1∶3∶1
(4)基因A与a、B与b分离;A与B(或b)随机组合发生在图(二)中___________时期。
(5)基因A与A、a与a、B与B、b与b的分离发生在图(二)中___________时期。
(6)图(二)所示细胞分裂方式与图(三)中过程Y的细胞分裂方式相比,最本质区别是___________。
(7)如果图(三)中个体甲同时患有白化病和血友病两种遗传病,而乙以及其父母均正常,若乙长大后与一正常男性结婚,已知该地区白化病患者占人群的万分之一,则他们所生子女同时患两种病的几率为___________。
答案:(1)A (2)B (3)A B C D
(4)D (5)G
(6)染色体数目减半
(7)1/2 400
(每空2分)
解析:在减数分裂过程中,分别位于同源染色体上的两对等位基因在减数第一次分裂的后期分离;非等位基因自由组合。减数分裂与有丝分裂的根本区别是染色体数目减半。
(7)(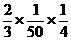 )×(
)×(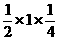 )=
)=
29.(18分)松油醇是一种调香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
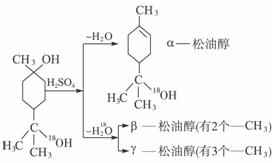
试完成下列问题:
(1)α-松油醇的分子式为_____________。
(2)α-松油醇所属的有机物类别是_____________。
a.醇 b.酚 c.饱和一元醇
(3)α-松油醇能发生的反应类型是_____________。
a.加成 b.水解 c.氧化
(4)在许多香料中松油还有少量以酯的形式出现,写出RCOOH和α-松油醇反应的化学方程式_______________________________________。
(5)写结构简式:β-松油醇_____________,γ-松油醇_____________。
答案:(1)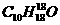
(2)a (3)ac
(4)
 (5)
(5)

(每空3分)
解析:由α-松油醇的结构简式可以看出,-OH直接与链烃基相连,应是醇;分子中含有环状结构且有双键,应属于不饱和醇,能发生加成反应,也能被氧化。A在脱水发生消去反应时,如果是环上的-OH发生消去,得α-松油醇;如果是侧链上的-OH发生消去反应,去氢的位置有两种,一种是去侧链上的氢,得β-松油醇,另一种是去环上的氢,得γ-松油醇。
0.024 5×0.05 0.039 2 g
W(S)=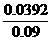 ×100%=43.6%
×100%=43.6%
28.(18分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:

实验时有如下操作:
A.将磁管中样品加热到800-850 ℃。
B.称取研细的黄铁矿样品。
C.连接好全部仪器,并检查其气密性。
D.将样品小心放入硬质磁管中部。
E.以均恒的速度不断鼓入空气。
F.用标准碘溶液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤的次序是(以A、B……的序号表示)_______________。
(2)装置①的作用是_______________;装置②的作用是_______________。
(3)碘跟SO2水溶液反应的离子方程式是_____________________________________。
(4)根据______________________________现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点_______________(填“是”或“否”),请说出你的主要理由_______________________。
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.090 0 g,滴定管中碘溶液的初读数为1.10 mL,末读数为25.60 mL,标准碘溶液的浓度为0.050 0 mol·L-1,则该黄铁矿样品中硫元素的质量分数为_______________。
.答案:(1)CBDEAF(3分)
(2)除去空气中CO2等酸性气体及还原性气体
除去水蒸气(4分)
(3)I2+SO2+2H2O====4H++ +2I-(2分)
+2I-(2分)
(4)溶液恰好成蓝色且半分钟不褪色(2分)
(5)是。固体与气体反应,固体很难反应完全(或燃烧不充分)或溶于水的SO2部分被O2氧化。(4分)
(6)43.6%(3分)
解析:根据题意,测定黄铁矿中硫元素的质量分数,应测定硫铁矿燃烧后生成的二氧化硫的物质的量。要做到这一点,应保证以下几点:①硫铁矿燃烧完全;②生成的二氧化硫全部被水吸收;③在用碘溶液滴定含淀粉的SO2水溶液之前,一定要确保二氧化硫不变质。这样,通入的提供氧气的空气中二氧化碳等酸性气体及水蒸气一定要除净,并在吸收二氧化硫的过程中要不吸收出气管可能进入的氧气。弄清了这些问题,就不难回答以上各小题。
第(6)问:I2 SO2
SO2 S
S
1 mol 32 g
27.(12分)在一个固定容积的密闭容器中,保持一定的温度,在一定条件下进行以下反应:?A(g)+3B(g) 3C(g),已知加入1 mol A和3 mol B,平衡时A的物质的量为a mol。
3C(g),已知加入1 mol A和3 mol B,平衡时A的物质的量为a mol。
(1)达到平衡时C在反应混合气体中的百分含量是______________(用含有a的关系式表示)。
(2)在相同的实验条件下,若在同一个容器中改为加入2 mol A和6 mol B,达到平衡后,?C的物质的量为______________mol,此时C在混合气体中的百分含量______________(填“增大”“减小”或“不变”)。
(3)若在同一个容器中改为加入2 mol A和3 mol B,能否通过调节C的物质的量,使平衡时C在混合气体中的百分含量与原平衡相同?(如果能,请写出C的物质的量,如不能,请说明通过什么方法可以实现)。
(4)在相同实验条件下,如果加入n mol A、m mol B和p mol C,若要求平衡后C在混合气体中的百分含量保持不变,则n、m与p的关系是_________________________________。
答案:(1)[3(1-a)/(3+a)]×100%
(2)大于6(1-a) 增大
(3)不能,可通过调节温度来实现。
(4)n+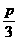 =1,m+p=3
=1,m+p=3
(每空2分)
解析:(1)平衡时A的物质的量为a mol,说明参加反应的A为(1-a) mol,利用化学方程式可计算出平衡时C的物质的量为3(1-a) mol,C在反应混合气体中的百分含量是[3(1-a)/(3+a)]×100%
(2)在同一个容器中改为加入2 mol A和6 mol B,相当于原混合体系加压使压强增至原来的2倍,平衡右移,所以C的浓度比原来的2倍还要大,即大于6(1-a),C在混合气体中的百分含量增大。
(3)若在同一个容器中改为加入2 mol A和3 mol B,不管C的物质的量为多少,平衡时C在混合气体中的百分含量与原平衡时都不可能相同。因为我们可以先将C转化为A,这样便可看出A与B的物质的量都不可能为1 mol A和3 mol B,也就是C的百分含量要发生改变。可通过调节温度来实现。
(4)可将C转化为反应物A和B,由于容器的体积不变,要使C的百分含量不变,必须保证A、B的起始量与原起始量相同。所以n+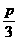 =1,m+p=3。
=1,m+p=3。
26.(12分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)A分子的空间构型为______________;B分子的电子式为______________;B发生反应生成1 mol A时放出的热量为46.2 kJ,写出该反应的热化学方程式______________________。
(2)实验室制取A的化学反应方程式为____________________________________________。
(3)E具有不稳定性,因此实验室中保存E的方法是_________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式___________________________;当反应中转移的电子为3 mol时,被氧化的A在标准状况下的体积为_________________L。
答案:(1)三角锥形 ∶N 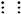 N∶
N∶
N2(g)+3H2(g)  2NH3(g);
2NH3(g);
ΔH=-92.4 kJ·mol-1
(2)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3)贮存在棕色瓶中,置于冷暗处
(4)8NH3+3Cl2====6NH4Cl+N2 22.4(转移3 mol e--被氧化1 mol NH3)
(第一空、第二空每空1分,其余每空2分)
解析:A、B、C、D、E均含元素Y,且Y在这些物质中所呈化合价依次升高,则Y元素至少有5种化合价,则一般为Cl或N,B为单质。常温下将气体D通入水中可发生反应,则只能为NO2+H2O NO+HNO3,则A、B、C、D、E依次为NH3、N2、NO、NO2、HNO3。
NO+HNO3,则A、B、C、D、E依次为NH3、N2、NO、NO2、HNO3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com