
题目列表(包括答案和解析)
32.(8分)[化学--物质结构与性质]
图表法、图象法是常用的科学研究方法。
I.某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。

II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ,理由是: 。
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这种晶体的化学式,设计了如下实验:
a. 分别取等质量的两种配合物晶体的样品配成待测溶液;
b. 分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c. 沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的三分之二。则绿色晶体的化学式为 ,绿色晶体中含有的化学键类型有 。
31.(8分)[化学--化学与技术]
 某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
请回答以下问题:
(1)合成氨反应的化学方程式是 ,该反应在 (填设备名)中发生。沉淀池中发生的主要反应方程式是 ,该反应能够发生的原因 。
(2)在上述流程的沉淀池中通入足量氨气的目的是 。
(3)该生产过程中的副产品是 。从绿色化学和资源综合利用的角度说明上述流程的主要优点是 ;从物质的性质和工业生产实际的角度考虑该流程的主要缺陷是 。
30.(15分)I.高铁(VI)酸盐是新一代水处理剂。其制备方法有:
①次氯酸盐氧化法(湿法) ②高温过氧化物法(干法)等
(1)①法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
(2)②法Na2O/FeSO4体系在N2中于100℃反应1h可得高铁(VI)酸盐,已知反应完成后固体质量减少4.15%。写出该法的化学方程式:
(3)②法要求混合反应物时,应在密闭容器中进行,原因是:
(4)Na2FeO4起消毒作用后,被还原为Fe‑3+,因此它还同时有 作用,理由是(用离子方程式表示): 。
II.用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
(1)写出正极发生的电极反应式: 。
(2)用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2 L(标准状况),同时生成Fe(OH)3= mol。
|
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(15分)I.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
 时间/s 时间/sc/mol·L-1 |
0 |
20 |
40 |
60 |
80 |
100 |
|
N2O4 |
0.20 |
a |
0.10 |
c |
d |
e |
|
NO2 |
0 |
0.12 |
b |
0.26 |
0.30 |
0.30 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)表中b c(填“<”、“=”、“>”)。0~20s内N2O4的平均反应速率为 。
(2)80℃时,该反应的平衡常数K= 。
(3)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2有浓度之比越大 D.正反应进行的程度越大
(4)要增大该反应的K值,可采取的措施 。
A.增大N2O4起始浓度 B.向混合气中通入NO2
C.使用高效催化剂 D.升高温度
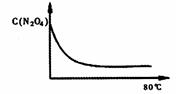 (5)如图是80℃时容器中N2O4浓度的变化图,
(5)如图是80℃时容器中N2O4浓度的变化图,
请在该图中补画出该反应在60℃反应时
N2O4浓度的变化曲线。
(6)已知某压强下上述反应的△H=+57.2kJ/mol,
△S=+210J/(mol·K),则N2O4在-5℃时能
否分解 。(填“能”或“不能”)
 II.已知,在1273K时可逆反应:Fe(s)+H2O(g) FeO(g)+H2(g)的平衡常数K=1.5;向容积为2.0L的密闭容器中投入0.80mol还原铁粉,充入水蒸气至浓度为0.50mol·L-1,加热到1273K。
II.已知,在1273K时可逆反应:Fe(s)+H2O(g) FeO(g)+H2(g)的平衡常数K=1.5;向容积为2.0L的密闭容器中投入0.80mol还原铁粉,充入水蒸气至浓度为0.50mol·L-1,加热到1273K。
(1)当反应进行到c[H2O(g)]=0.25mol·L-1,试判断该反应是否达到平衡?简述判断依据。
(2)当反应达到平衡后,求密闭容器中H2O(g)的物质的量。
28.(12分)A、B、C、D为四种常见元素,A的一种单质在雷雨天、静电复印时均可产生,常用于游泳池消毒;B的最高价氧化物水化物是一种常见的液态干燥剂。C、B同周期,C和A组成的一种化合物可用于呼吸面具供氧。D的单质常温下是深红棕色液体。
(1)写出A、C的元素符号:A: C: 。
(2)将A、B组成的气态化合物通入D单质的水溶液中,可观察到的现象是 ,写出发生反应的离子方程式,并标出电子转移方向和数目。
(3)已知:B的气态氢化物的水溶液与A、B组成的气态化合物的水化物的水溶液均呈酸性。今欲确定这两种酸的酸性强弱,请你设计实验方案。
(4)试证明:B与D何种元素的非金属性更强。请用化学方程式表示你所设计实验的反应原理: 。
27.(15分)果蝇的长翅(A)对残翅(a)、正常肢(B)对短肢(b)、后胸正常(D)对后胸变形(d)、红眼(E)对白眼(e)分别为显性,控制这些性状的基因可能位于X(I)、II、III这3对同源染色体上,请回答下列问题:
(1)基因与染色体的关系为:每一个染色体上含有许多基因,基因在染色体上呈
。
(2)果蝇性状中的残翅、短肢、后胸变形、白眼是由于 导致的。
(3)已知果蝇红眼(E)对白眼(e)这一对等位基因位于X(I)号染色体上。请写出能根据果蝇后代眼色就识别出性别的亲本组合? (写表现型)
(4)实验室内有各种已知表现型和基因型的雌、雄果蝇若干,请任意选取两对性状的表现型和符合要求的基因型,用一次杂交确定控制这2对性状的基因是否位于两对同源染色体上。(请用遗传图解表示推理过程)
26.(18分)甲图和乙图表示某植物在适宜的CO2条件下光合作用速度与环境因素之间的关系丙图是绿色植物新陈代谢的图解。据图回答:
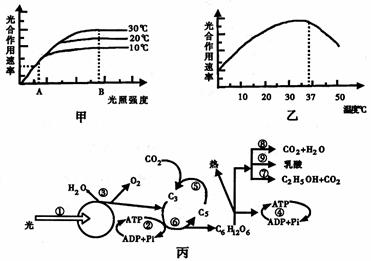
(1)甲图中的“光合作用速率”指的是 光合速率(填“净”或“真正”),B点光合作用的速率主要受 的限制,据此原理在冬季农业生产可采用哪些措施提高农作物产量? 。在温度为30℃的情况下,若光照强度突然由A变为B,短时间内叶肉细胞中C3的量会 。
(2)乙图表示光照强度为B时,植物光合速率随温度的变化曲线。请据甲图,在乙图中绘制光照强度为A时,不同温度(10℃~30℃)下,光合速率的变化曲线。
(3)丙图中,③和⑦过程发生的场所分别是 。
(4)对于旺盛生长的植物而言,②和④两个过程形成ATP较多的是 。
(5)人在剧烈运动时,也可以进行⑨过程,此时人体依靠 来维护内环境pH的相对稳定。
25.(18分)如下图甲所示,真空中两水平放置的平行金属板C、D,上面分别开有正对的小孔O1和O2,金属板C、D接在正弦交流电源上,C、D两板间的电压UCD随时间t变化的图线如图(乙)所示。t=0时刻开始,从D板小孔O1处连续不断飘入质量为m=3.2×10-25kg、电荷量q=1.6×10-19C的带正电的粒子(设粒子飘入速度很小,可视为零)。在C板外侧有以MN为上边界CM为左边界的匀强磁场,MN与C金属板相距d=10cm,O2C的长度L=10cm,匀强磁场的大小为B=0.1T,方向如图(甲)所示,粒子的重力及粒子间相互作用力不计,平行金属板C、D之间的距离足够小,粒子在两板间的运动时间可忽略不计。求:
(1)带电粒子经小O2进入磁场后,能飞出磁场边界MN的最小速度为多大?
(2)从0到0.04s末时间内哪些时间段飘入小O1的粒子能穿过电场并飞出磁场边界MN。
(3)磁场边界MN有粒子射出的长度范围。(计算结果保留一位有效数字)
24.(16分)如图是为了检验某种防护罩承受冲击力的装置,M是半径为R=1.0m的固定于竖直平面内的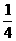 光滑圆弧轨道,轨道上端切线水平。N为待检验的固定曲面,该曲面在竖直面内的截面为半径
光滑圆弧轨道,轨道上端切线水平。N为待检验的固定曲面,该曲面在竖直面内的截面为半径 的
的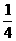 圆弧,圆弧下端切线水平且圆心恰好位于M轨道的上端点。M的下端相切处放置竖直向上的弹簧枪,可发射速度不同的质量m=0.01kg的小钢珠,假设某次发射的钢珠沿轨道恰好能经过M的上端点,水平飞出后落到曲面N的某一点上,取g=10m/s2。求:
圆弧,圆弧下端切线水平且圆心恰好位于M轨道的上端点。M的下端相切处放置竖直向上的弹簧枪,可发射速度不同的质量m=0.01kg的小钢珠,假设某次发射的钢珠沿轨道恰好能经过M的上端点,水平飞出后落到曲面N的某一点上,取g=10m/s2。求:
(1)发射该钢球前,弹簧的弹性势能EP多大?
 (2)钢珠从M圆弧轨道最高点飞出至落到圆弧N上所用的时间是多少(结果保留两位有效数字)?
(2)钢珠从M圆弧轨道最高点飞出至落到圆弧N上所用的时间是多少(结果保留两位有效数字)?
2.第II卷所有题目的答案考生须用黑色签字笔、钢笔或圆珠笔答在答题纸上,在试题卷上答题无效。
[必做部分]
 23.(11分)如下图甲所示为测量电动机转动角速度的实验装置,半径不大的圆形卡纸固定在电动机转轴上,在电动机的带动下匀速转动。在圆形卡纸旁边垂直安装一个改装了的电火花计时器。
23.(11分)如下图甲所示为测量电动机转动角速度的实验装置,半径不大的圆形卡纸固定在电动机转轴上,在电动机的带动下匀速转动。在圆形卡纸旁边垂直安装一个改装了的电火花计时器。
(1)请将下列实验步骤按先后顺序排序:
。
①使电火花计时器与圆形卡纸保持良好接触
②接通电火花计时器的电源,使它工作起来
③启动电动机,使圆形卡纸转动起来
④关闭电动机,拆除电火花计时器,研究卡纸
上留下的一段痕迹(如图乙所示),写出角速
度ω的表达式,代入数据,得出ω的测量值
(2)要得到角速度ω的测量值,还缺少一种必要
的测量工具,它是( )
A.秒表 B.毫米刻度尺 C.圆规 D.量角器
(3)写出ω的表达式,并指出表达式中各个物理的意义:
。
(4)为了避免在卡纸连续转动的过程中出现打点重叠,在电火花计时器与盘面保持良好接触的同时,可以缓慢地将电火花计时器沿圆形卡纸半径方向向卡纸中心移动。则卡纸上打下的点分布曲线将不是一个圆,而是类似一种螺旋线(如图丙所示)。这样做测量结果将 (填“偏大”、“偏小”或“不变”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com