
题目列表(包括答案和解析)
49.为了测定黄铜(铜、锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入足量的稀硫酸后,依次测量t1 ~ t5时产生氢气的总质量,记录的数据见下表:
|
反应时间/s |
t1 |
t2 |
t3 |
t4 |
t5 |
|
生成H2的总质量/g |
0.03 |
0.06 |
0.08 |
0.10 |
0.10 |
(1)该反应共生成氢气_______g;
(2)计算黄铜样品中铜的质量分数。
B组题:
48. 在下图所示的变化中,A是一种白色固体,D和E都是不溶于稀硝酸的白色沉淀,请回答:
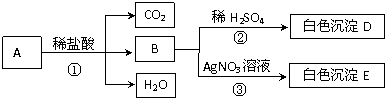
(1)A的化学式为 ;白色沉淀E是 。
(2)反应②的化学方程式为 。
47. 将下列各组物质混合后溶于水,得到无色溶液的是……………………………………( )
A. KNO3、ZnCl2、Na2SO4 B.FeCl3、NaOH、KNO3
C. CuSO4、NH4Cl、ZnCl2 D. CaCl2、Na2CO3、KCl
45.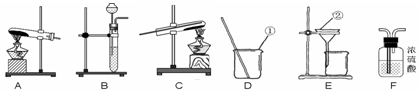 今天是实验室的开放日,某小组的同学利用下列装置进行实验。
今天是实验室的开放日,某小组的同学利用下列装置进行实验。

(1)写出图中指定仪器的名称:① ;② ;
(2)要制取干燥的H2,并用H2还原氧化铜,应选取的装置为____________(填装置编号)。在氢气还原氧化铜的过程中,同学们能观察到的现象是__________________________。
(3)若制取氢气时需要100g 9.8%的稀硫酸,配制上述稀硫酸需要98%的浓硫酸(密度为1.84g/cm3)__________mL。配制过程中,除上图装置中的仪器外,还缺少的仪器有________________________________(填序号)。
①天平 ②胶头滴管 ③药匙 ④10mL量筒 ⑤100mL量筒
(4)还原氧化铜的实验结束后,同学们发现得到的铜中还混有未反应的氧化铜。为了得到纯净的铜,他们进行了以下实验操作:
|
操作 |
简答 |
|
①将反应后的固体放入烧杯中,加入足量的稀硫酸,搅拌,使其充分反应。 |
加足量稀硫酸的目的是: ______________________________________ |
|
②将操作①中所得的混合物过滤。 |
滤液中所含有的溶质是: ______________________________________ |
|
③将操作②所得的滤渣洗涤、烘干,得到纯净的铜。 |
|
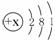 A组
A组
46. 某元素原子结构示意图为 ,则x的值为_________。根据元素原子结构示
意图,不能直接获得的信息是________(填编号)。
A. 核电荷数 B. 相对原子质量 C. 电子层数 D. 最外层电子数
43. 绪言课上,老师表演了一个化学魔术:在A、B两只盛有无色液体的玻璃杯中,分别倒入装在酒瓶中的NaOH溶液,观察到下列现象:A杯中变为“葡萄酒”(变成红色);B杯中变为“牛奶”(产生白色沉淀)。请你揭开该魔术的秘密:
(1)A杯中盛放的液体是_______________;(2)B杯中盛放的液体是_______________。
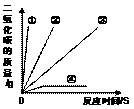 44.为了选择实验室制取二氧化碳的反应物,某实验小组取等量的碳酸盐和足量等浓度的酸,设计了以下四种反应物组合进行探究实验,结果如下图所示。
44.为了选择实验室制取二氧化碳的反应物,某实验小组取等量的碳酸盐和足量等浓度的酸,设计了以下四种反应物组合进行探究实验,结果如下图所示。
|
(1)根据实验结果,他们决定选择大理石与稀盐酸来制取二氧化碳,发生反应的化学方程式为___________________________________。他们不选择①和④的原因分别是______________________________________________________________________。
(2)探究结果说明,影响碳酸盐与酸反应产生二氧化碳快慢的因素有______________________________________________________________________。
42.(1)食品干燥剂生石灰吸收水分时发生反应的化学方程式为_______________________;
(2)熟石灰水溶液的pH____7(填“>”、“<”或“=”),因此在农业上熟石灰可用来
__________________________________________。
(3)已知30℃时熟石灰的溶解度为0.16g/100g水,则30℃时50g水中最多能溶解____g
熟石灰,将所得饱和溶液升温到50℃时,溶液是否饱和?_______(填“是”或“否”)。
41. 地壳中含有大量的硅元素,它的含量仅次于
元素。高纯度的单质硅是计算机的核心材料,工业上制取单质硅的第一步反应的化学方程式为:SiO2+2C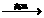 Si+2R,其中R的化学式为
;该反应属于基本反应类型中的
反应。
Si+2R,其中R的化学式为
;该反应属于基本反应类型中的
反应。
40. 在①氧气、②金刚石、③氢气、④盐酸四种物质中,可用于除去铁锈的是(填序号,下同)______;可以供给呼吸的是_______;可作为新型气体燃料的是_______。
39. 北京奥运会圣火传递活动中火炬使用的燃料是丙烷(C3H8),一个丙烷分子中共有
个原子,其中碳氢元素的质量比为 。丙烷充分燃烧后生成二氧化碳和水,该反应的化学方程式为 。
38. 如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,现将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,下列有关叙述中正确的是……………………………………………………( )
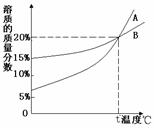 A.t℃时,A溶液的质量百分比浓度(溶质质量分数)小于B
A.t℃时,A溶液的质量百分比浓度(溶质质量分数)小于B
B.t℃时,A、B溶液均达到饱和状态
C.t℃时,A、B溶液中均无固体物质析出
D.t℃时,A物质的溶解度小于B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com