
题目列表(包括答案和解析)
(一) 苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;在催化剂的作用下,苯环上的氢原子被卤素原子取代。

13.海王星是绕太阳运动的一颗行星,它有一颗卫星叫海卫三。若将海王星绕太阳的运动和海卫三绕海王星的运动均看作匀速圆周运动,则要计算海王星的质量,需要知道的量是(引力常量G为已知量)
A.海卫三绕海王星运动的周期和半径
B.海王星绕太阳运动的周期和半径
C.海卫三绕海王星运动的周期和海卫三的质量
D.海王星绕太阳运动的周期和太阳的质量
14.如图所示,一个质量为0.18kg的垒球,以25m/s的水平速度飞向球棒,被球棒打击后反向水平飞回,速度大小变为45m/s,设球棒与垒球的作用时间为0.01s。则
A.球棒对垒球的平均作用力大小为1260N
B.球棒对垒球的平均作用力大小为360N
C.球棒对垒球做的功为126J
D.球棒对垒球做的功为36J
15.如图所示,由两块相互靠近的平行金属板组成的平行板电容器的极板N与静电计相接,极板M接地。用静电计测量平行板电容器两极板间的电势差U。在两板相距一定距离d时,给电容器充电,静电计指针张开一定角度。在整个实验过程中,保持电容器所带电量Q不变,下面哪些操作将使静电计指针张角变小
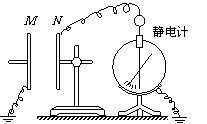 A.将M板向下平移
A.将M板向下平移
B.将M板沿水平向左方向远离N板
C.在M、N之间插入云母板(介电常数ε>1)
D.在M、N之间插入金属板,且不和M、N接触
16.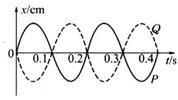 一列简谐横波沿绳子传播时,绳上有相距3m的P点和Q点,它们的振动图线如图所示,其中实线为P点的图线,虚线为Q点的图线。则该列波的波长和波速的可能值为
一列简谐横波沿绳子传播时,绳上有相距3m的P点和Q点,它们的振动图线如图所示,其中实线为P点的图线,虚线为Q点的图线。则该列波的波长和波速的可能值为
A.6m,30m/s B.6m,12m/s
C.2m,12m/s D.2m,10m/s
17. 如图所示,一光滑平行金属轨道平面与水平面成θ角,两导轨上端用一电阻R相连,该装置处于匀强磁场中,磁场方向垂直轨道平面向上。质量为m的金属杆ab,以初速度v0从轨道底端向上滑行,滑行到某一高度h后又返回到底端。若运动过程中,金属杆保持与导轨垂直且接触良好,并不计金属杆ab的电阻及空气阻力,则
如图所示,一光滑平行金属轨道平面与水平面成θ角,两导轨上端用一电阻R相连,该装置处于匀强磁场中,磁场方向垂直轨道平面向上。质量为m的金属杆ab,以初速度v0从轨道底端向上滑行,滑行到某一高度h后又返回到底端。若运动过程中,金属杆保持与导轨垂直且接触良好,并不计金属杆ab的电阻及空气阻力,则
A.上滑过程的时间比下滑过程长
B.上滑过程通过电阻R的电量比下滑过程多
C.上滑过程通过电阻R产生的热量比下滑过程多
D.上滑过程金属杆克服安培力做的功比下滑过程小
18.如图,是一火警报警电路的示意图。其中R3为用某种材料制成的传感器,这种材料的电阻率随温度的升高而增大。值班室的显示器为电路中的电流表,电源两极之间接一报警器。当传感器R3所在处出现火情时,显示器的电流I、报警器两端的电压U的变化情况是

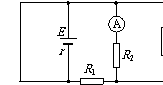 A.I变大,U变小
A.I变大,U变小
B.I变小,U变大
C.I变小,U变小
D.I变大,U变大
第Ⅱ卷 必考部分
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
(1)一滑块自左向右运动,现用频闪照相机在同一张底片上多次曝光,记录下滑块每次曝光时的位置,如图所示。连续两次曝光的时间间隔为0.1 s,则滑块的加速度大小为________m/s2,滑块在第1次曝光时的速度大小为________m/s。
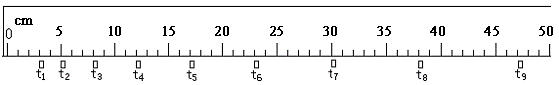 (2)某同学要用伏安法测定一个待测电阻
(2)某同学要用伏安法测定一个待测电阻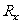 的阻值(阻值约为
的阻值(阻值约为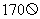 ),实验室提供了如下器材可供选择:
),实验室提供了如下器材可供选择:
电池组E(电动势为3V,内阻不计);
电流表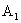 (量程为
(量程为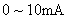 ,内阻约为
,内阻约为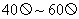 );
);
电流表 (量程为
(量程为 ,内阻为
,内阻为 );
);
滑动变阻器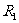 (阻值范围为
(阻值范围为 ,额定电流为1A);
,额定电流为1A);
电阻箱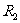 (阻值范围为
(阻值范围为 ,额定电流为1A);
,额定电流为1A);
开关S,导线若干。
请你帮助该同学完成实验中的下述问题(实验中应尽可能的考虑更加准确地测量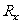 的阻值):
的阻值):
① 上述器材中因缺少电压表,需选一只电流表将它改装成电压表。请在图甲所示虚线框中画出将电流表改装成电压表的电路原理图。


② 请在图乙的虚线框中画出测量Rx阻值的电路图,并在图中标明各器材的代号。
③ 实验中,将电阻箱R2的阻值调为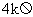 ,再调整滑动变阻器R1,使电流表A2的示数是
,再调整滑动变阻器R1,使电流表A2的示数是 ,此时电流表A1的示数是
,此时电流表A1的示数是 ,则通过
,则通过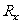 的电流是
mA,测出
的电流是
mA,测出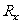 的阻值是
的阻值是
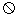 。
。
20.(15分) 为了安全,在公路上行驶的汽车之间应保持必要的距离。我国公安部门规定:高速公路上行驶汽车的安全距离为200m,汽车行驶的最高速度为120km/h。请你根据下面提供的资料,通过计算来说明安全距离为200m的理论依据。
资料一:驾驶员的反应时间:0.3s~0.6s之间
资料二:各种路面与轮胎之间的动摩擦因数:
|
路面 |
动摩擦因数 |
|
干沥青与混凝土路面 |
0.7-0.8 |
|
干碎石路面 |
0.6-0.7 |
|
湿沥青与混凝土路面 |
0.32-0.4 |
(1)在计算中驾驶员的反应时间应该取多少?为什么?
(2)在计算中路面与轮胎之间的动摩擦因数应该取多少?为什么?
(3)通过你的计算来说明200m为必要的安全距离。
21.(19分)如图所示,光滑绝缘的细圆管弯成半径为R的半圆形,固定在竖直面内,管口B、C的连线是水平直径.现有一带正电的小球(可视为质点)从B点正上方的A点自由下落,A、B两点间距离为4R。从小球进入管口开始,整个空间中突然加上一个匀强电场,电场力在竖直向上的分力大小与重力大小相等,结果小球从管口C处脱离圆管后,其运动轨迹经过A点。设小球运动过程中带电量没有改变,重力加速度为g,求:
 (1)小球到达B点的速度大小;
(1)小球到达B点的速度大小;
(2)小球受到的电场力的大小和方向;
(3)小球经过管口C处时对圆管壁的压力。
22.(20分) 如图所示为一种获得高能粒子的装置--环形加速器。环形区域内存在垂直纸面向外的匀强磁场,磁场的磁感应强度大小可调节。质量为m、电量为+q的粒子可在环中做匀速圆周运动。P、Q为相距很近的两块中心开有小孔的极板,最初两极板电势都为零,每当粒子飞至P板时,P板电势变为+U,Q板电势仍保持为零,每当粒子离开Q板时,P板电势立即变为零。粒子在P、Q两板间电场的一次次加速下动能不断增大,而粒子的绕行半径通过磁场的调节保持为R不变。粒子经过P、Q极板的时间极短,可忽略不计。设t=0时刻,粒子静止在P板小孔处,在电场作用下加速,并绕行第一圈。
(1)为使粒子始终在半径为R的圆轨道上运动,磁场必须周期性递增。求粒子从t=0时刻起绕行第n圈时的磁感应强度 ;
;
(2)求粒子从t=0时刻起绕行n圈回到P板所需的总时间 。
。
23.(15分)A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F。D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体。
 (1)B的元素名称是________,C单质的电子式是
__________。
(1)B的元素名称是________,C单质的电子式是
__________。
(2)A、B两元素还能形成一种比D相对分质量大16的化合物,请写出该化合物的一种用途________;A、C两元素也还能形成一种比E相对分子大16的化合物,请写出实验室制备该化合物反应的化学方程式__________ _____。
(3)E、F在一定条件下可以发生反应生成C元素的单质和D,该反应中氧化产物与还原产物的物质的量之比为_____________。
(4)A、B、C三种元素能组成一种原子个数比为3:4:2的常见离子化合物,0.1mol·L-1的该化合物的水溶液中,溶液显 性(填“酸”、“碱”、“中”),用离子方程式解释原因 ,
该溶液中离子浓度由大到小的顺序是 。
24.(15分)实验方案的设计应明确实验目的,根据实验原理,选择合适的实验仪器,经过合理的实验步骤,采集必要的数据,完成实验并对结果进行分析。实验室有一些氧化铜和铜粉的混合物,欲知道其各组分的含量,设计了如下实验方案。
方案一:
㈠实验目的:测定氧化铜与铜的混合物中氧化铜和铜的质量分数。
㈡实验原理:氧化铜可溶于稀硫酸而铜与稀硫酸不反应。
㈢实验用品
天平,烧杯,玻璃棒,漏斗架,滤纸,干燥器,仪器甲;硫酸(3mol/L),试纸乙,混合物样品。
㈣实验步骤
① 用天平称取混合物m1g混合物倒入烧杯中。
② 向烧杯中加入过量的硫酸使氧化铜完全溶解。
③ 过滤,留取滤渣铜粉。
④ 将③中所得铜粉洗净后移入干燥器干燥。
⑤ 称量铜粉的质量为m2g。
㈤根据所记录的数据计算原混合物中氧化铜的质量分数和铜的质量分数。
方案二:
㈠实验目的:测定氧化铜与铜的混合物中氧化铜和铜的质量分数。
㈡实验原理:铜在加热条件下易被空气中氧气氧化而氧化铜在同样条件下相对稳定。
㈢实验用品
天平,酒精灯,坩埚,坩埚钳,三脚架,泥三角,干燥器;混合物样品。
㈣实验步骤
① 用天平称坩埚的质量为m1g,坩埚与混合物样品的总质量为m2g。
② 在空气中小心加热样品。
③ 。
④ 重复步骤②③至坩埚和样品恒重,为m3g。
㈤根据所纪录的数据计算原混合物中氧化铜的质量分数和铜的质量分数。
回答下列问题:
⑴方案一中仪器甲的名称是 ,试纸乙是 。
⑵方案一中确定所加硫酸已足量的方法是
。
⑶方案一中步骤④若没有用水洗净,则所测铜的质量分数结果 (填“偏高”、“偏低”或“无影响” )
⑷方案二中所缺步骤③的内容是 。
⑸方案二中步骤④的目的是 。
25.(15分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30-50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400-500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K和x的关系满足K= 。若温度为400℃,平衡常数为K2,则K1 K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。
①写出CO燃烧的热化学方程式 。
② 2H2(g) + O2(g)== 2H2O(g) △H= kJ/mol
26.(24分)
Ⅰ.一个用32P标记的DNA分子,放在含31P的四种脱氧核苷酸的培养基中,让其连续复制3次。
(1)除上述几种物质外,还必须有 和 才能合成子代DNA分子。DNA 复制的特点是___________。
(2)含 31P的DNA分子占全部DNA的比例是 ,含32P的单链占全部单链的
(3)DNA亲子鉴定中,DNA探针必不可少,DNA 探针实际是一种已知碱基序列的DNA 片断。请问:DNA探针检测基因所用的原理是___________。
Ⅱ.(1)育种专家在纯种高茎小麦地里,发现了一株矮化植株,这可能是___________的结果,也可能是___________造成的。
(2)若经鉴定上述矮化植株是基因突变的结果,矮化植株究竟是显性突变,还是隐性突变,请用所学生物学知识设计实验进行鉴定,并作出预测和结论。
(3)基因突变是指DNA 分子中发生碱基对的替换、增添和缺失而引起的基因结构的改变。若发生在___________中,一般将遵循遗传规律传递给后代;而若发生在体细胞中,一般不能遗传。
27. (16分)下图为一学生做植物向光性实验的小苗(从种子萌发开始就照射不同方向的单方向的光)。
I.从苗茎长的形态来看,该学生用单方向光照射苗茎顶端,曾先后使用了________次不同的光线照射方向,最初光照的方向是___________,
 II.该学生发现不同颜色的单侧光引起小苗向光性的弯曲程度不同,因此进一步做了以下探究实验:
II.该学生发现不同颜色的单侧光引起小苗向光性的弯曲程度不同,因此进一步做了以下探究实验:
(1)实验题目:探究不同颜色的单侧光对小苗向光性的弯曲程度的影响。
(2)材料用具:玉米幼苗、小花盆、泥土、台灯(60瓦灯泡)、玻璃纸(蓝色、绿色、黄色、红色)不透光的纸盒、火柴杆、量角器、剪刀等
(3)实验步骤:
① 用剪刀在不透光的纸盒一侧挖一切出 3×8 cm2长方形洞孔,再贴上不同颜色的玻璃纸。
② 将等量且长势相同但真叶尚未出胚芽鞘的玉米幼苗分成A、B、C、D、E四组,分别放入贴有紫色、蓝色、绿色、黄色、红色玻璃纸的纸盒中。
③ 把整个装置置于黑暗的环境中,用台灯在距离植物20-30cm处进行照射,其它条件相同且适宜。
④ 每天测量并记录玉米幼苗的弯曲程度,观察3天内的变化。
(4)预测实验结果及结论:
① 若A、B、C、D、E五组弯曲程度相同,则说明不同颜色的单侧光对小苗向光性的弯曲程度的影响相同;
② 若弯曲程度A﹥B﹥C﹥D﹥E,则说明_________________________
③ 若弯曲程度A﹤B﹤C﹤D﹤E,则说明_____________________
④ 若弯曲程度E﹥A=D﹥B=C,则说明__________________________
⑤ 若A、B、C、D、E五组弯曲程度无规律,则说明不同颜色的单侧光对小苗向光性的弯曲程度的影响无规律。
III.若小苗在单侧光蓝光下弯曲的程度大于小苗在单侧光红光下的弯曲程度,请验证这一结论。
① 材料用具:玉米胚芽鞘若干、空白琼脂块、刀片、光照设备
② 实验步骤:
ⅰ.____________________________,平均分成A、B两组分别放在空白琼脂块上,A组用单侧光蓝光照射,B组用单侧光红光照射。
ⅱ.一段时间后,将A组琼脂块放在切去尖端的胚芽鞘甲的顶端一侧,将B组琼脂块放在切去尖端的胚芽鞘乙的顶端一侧。
ⅲ.一段时间后,观察___________________________
③ 结果及结论:__________________________________________ 选考部分
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卷选答区域的指定位置上。
28.(物理--选修3-3,本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
 (1)如图所示的实验装置中,把浸有乙醚的一小块棉花放在厚玻璃筒内底部,当很快向下压活塞时,由于被压缩的气体骤然变热,温度升高达到乙醚的燃点,使浸有乙醚的棉花燃烧起来。这个实验说明了 。(填选项前的编号)
(1)如图所示的实验装置中,把浸有乙醚的一小块棉花放在厚玻璃筒内底部,当很快向下压活塞时,由于被压缩的气体骤然变热,温度升高达到乙醚的燃点,使浸有乙醚的棉花燃烧起来。这个实验说明了 。(填选项前的编号)
① 做功可以增加物体的热量 ② 做功可以改变物体的内能
③ 做功一定会升高物体的温度 ④ 做功一定可以使物态发生变化
(2)房间里气温升高3℃时,房间内的空气将有1%逸出到房间外。由此可计算出房间内原来的温度是 。(填选项前的编号)
① 30℃ ②27℃ ③24℃ ④21℃
29.(物理--选修3-5,本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)在核反应方程式 中,下列关于X和k的判断正确的是
中,下列关于X和k的判断正确的是
。(填选项前的编号)
① X是中子,k=9 ② X是中子,k=10
③ X是质子,k=9 ④ X是质子,k=10
(2)质量分别为60㎏和70㎏的甲、乙两人,原来各自站立在静止于光滑水平面上的小车两端。现两人同时以3m/s的水平初速度沿相反方向跳离小车,若小车的质量为20㎏,则当两人跳离小车后,小车的运动速度为 。(填选项前的编号)
① 19.5m/s,方向与甲的速度方向相同
② 19.5m/s,方向与乙的速度方向相同
③ 1.5m/s,方向与甲的速度方向相同
④ 1.5m/s,方向与乙的速度方向相同
30.(化学--物质结构与性质,13分) Fe为过渡元素,它的原子序数为26。回答下列问题:
⑴ 铁元素基态原子的电子排布式为 ;
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② Fe(CN)64-中的配体是CN-,中心离子是 。
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
晶体,并推知铁与氯之间的作用力为 。
A.共价键 B.离子键 C.分之间作用力 D.氢键
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶
胞分别如右图所示。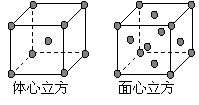 面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 。
面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 。
31.(化学--有机化学基础,13分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:

12.已知同一碳原子连有两个羟基不稳定: 。有机物
。有机物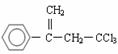 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快。下列有关该有机物的说法不正确的是
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快。下列有关该有机物的说法不正确的是
A.该物质能使酸性高锰酸钾溶液和溴水褪色
B.该物质是一种芳香烃
C.在碱性条件下充分水解,可生成羧酸盐
D.1mol 该物质在一定条件下可与4molH2发生加成反应
11.下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂,
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
10.随着科学技术的发展,化学研究的手段日趋先进,下列对技术在化学研究中的应用的说法中不正确的是 A.仅用红外光谱图即可确定复杂有机物的分子结构
B.用pH计测定溶液的pH
C.用质谱仪测定有机物的相对分子质量
D.用同位素示踪法研究有机反应的机理
9.下列叙述不正确的是
A.常温下,10mL0.02 mol/L HCl溶液与10mL0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
B.在0.1 mol/LHCOONa溶液中,C(OH-)=C(HCOOH)+C(H+)
C.中和物质的量与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,在由水电离出的 的溶液中,
的溶液中, 可能大量存在
可能大量存在
8.能正确表示下列反应的离子方程式是
A.向氯化铝溶液中加入过量氨水 Al3++ 4NH3·H2O=Al O2-+ 4NH4++2 H2O
B.向小苏打溶液中加入醋酸 CO32-+ 2CH3COOH=CO2↑+ H2O+ 2CH3COO-
C.碳酸氢钠溶液中加入氢氧化钠 HCO3-+OH-=CO32-+ H2O
D.稀硝酸中加入过量铜片 3Cu +8H++2NO3-=3Cu2++2NO2↑+4 H2O
7.产于台湾海峡的红珊瑚在中国是吉祥富有的象征,一直用来制做珍贵的工艺品。据分析其红色是因为含某种元素的氧化物,试推测该元素是
A.Na B.Mg C. Fe . D.Ca
6.食品安全关系到每个人的切身利益,以下做法对身体健康不会产生明显危害的是
A.用甲醛溶液浸泡海产品使之不易腐败
B.用谷氨酸钠作为味精主要成分
C.用烧硫磺方式将木耳熏白使其品相更好
D.在牛奶中添加三聚氰胺以提高牛奶的含氮量
5.下列关于突变与进化的关系,说法正确的是
A.突变使狼和鹿产生不定向变异,自然选择使它们向奔跑速度快的方向进化
B.有利的突变太少,不足作为生物进化的原始材料
C.突变是可遗传变异,都会遗传给下一代
D.物种的形成过程也就是种群基因频率发生定向改变的过程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com