
题目列表(包括答案和解析)
(二)(14分)某实验小组用下列装置进行乙醇催化氧化的实验:

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相反应的化学反应方程式
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是 反应。
(2)甲和乙两个水浴作用不相同
甲的作用是 ;乙的作用是 。
(3)反应一段时间后,将试管a中收集到的液体加入新制Cu(OH)2悬浊液中并加热;反
应的化学方程式为 。
(4)若试管a中收集到的液体用紫色石蕊试液检验,呈红色,说明溶液中还含有 ,
写出形成该物质的化学方程式 。要除去该物质,可先在混合液中加入______ (填写字母序号)。
a.NaCl溶液 b.苯 c.NaHCO3溶液 d.CCl4
然后,再通过 (填实验操作名称)即可除去。
29.(12分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
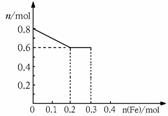 ⑴ 甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品的质量为 g。
⑴ 甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品的质量为 g。
⑵ 乙取样品②,反应后的溶液中既含有Fe3+,又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
⑶ 丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应
过程中溶液里Fe3+、Fe2+、NO3- 三种离子中的某种离子的物质的
量变化曲线如下图所示,则该曲线表示 离子物质的量变化的曲线;
(4)请你在此图中再画出另外两种离子的物质的量的变化曲线。
30.赤霉素广泛存在于高等植物体内,它可以通过提高生长素(吲哚乙酸)含量间接促进植物生长。那么它是如何提高生长素含量的呢?某研究小组开展了探究。
生长素在植物体内有一个合成和分解的代谢过程(如图1,IAA氧化酶是一种含铁蛋白)。研究小组据此提出假设:赤霉素通过促进生长素的合成提高生长素含量。

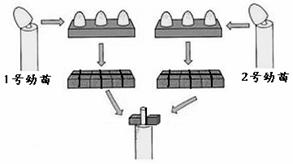
图1 图2
为验证假设,研究小组设计了实验。材料用具包括燕麦幼苗,完全培养液、缺铁培养液、赤霉素溶液(以上溶液浓度均适宜),蒸馏水、琼脂块、刀片等。
(1)参考图2,补充完成以下实验步骤:
① 准备四个配有培养支架的烧杯,分别标记为1-4号。
② 向1号和2号烧杯中加入等量适量的完全培养液。
③ _________________,分别在1号和2号烧杯中培养一段时间。
④ 1号幼苗喷洒适量蒸馏水,2号幼苗喷洒等量赤霉素溶液。继续培养一段时间。
⑤ ; .
培养一段时间后,观察胚芽鞘的弯曲情况。
⑥ 向3号和4号烧杯中加入等量适量的缺铁培养液, 。
(2)实验分析:
步骤②→⑤的处理结果是去尖胚芽鞘弯向1号,这证明 。步骤⑥可能出现 种不同的实验结果。
(3)该研究小组只提出了一种假设,请你提出可能存在的其他假设。
31.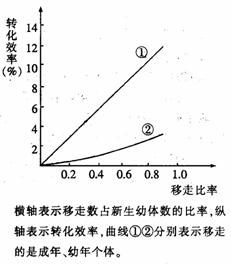 对生态系统中能量流动的研究可以在种群、食物链和生态系统三个层次上进行。下列是生态学家研究能量流动所做的实验:以一定速率加入单细胞藻喂养水蚤(通常全部被水蚤吃掉),并以不同速率移走水蚤,同时统计出移走不同年龄的个体对转化效率(移走水蚤的量/添加的单细胞藻量)的影响,结果如图。请分析回答:
对生态系统中能量流动的研究可以在种群、食物链和生态系统三个层次上进行。下列是生态学家研究能量流动所做的实验:以一定速率加入单细胞藻喂养水蚤(通常全部被水蚤吃掉),并以不同速率移走水蚤,同时统计出移走不同年龄的个体对转化效率(移走水蚤的量/添加的单细胞藻量)的影响,结果如图。请分析回答:
(1)水蚤在生态系统中属于_________(成分),该实验研究是在_______层次上的能量流动情况分析。
(2)研究表明水蚤的收获量总是远小于取食量,主要原因是_________,这体现了能量流动的特点是___________。
(3)实验结果表明移走成年个体比移走幼年个体转化效率高,原因是__________。
(4)研究结果表明,转化效率与_______有关。这项研究对渔业生产所具有的指导意义是_______。
沙市七中2009届高三理综测试卷四
(二)(10分). 为了测量量程为3V的电压表V的内阻(约为2000Ω),实验室可提供的器材有:
 电流表A(量程为0.6A,内阻约为0.1Ω)
电流表A(量程为0.6A,内阻约为0.1Ω)
电压表V/(量程为5V,内阻约为3500Ω)
电阻箱R1(0-9999Ω)
电阻箱R2(0-99.9Ω)
滑动变阻器(0-100Ω,额定电流1.5A)
电源E(电动势6V,内阻约为0.5Ω)
单刀单掷开关S、导线若干
(1)请从上述器材中选择必要的器材,设计一个测量电压表V内阻的实验电路.在右面的方框中画出电路原理图,图中元件要用题中相应的字母标注,并要求测量尽量准确
(2)写出计算电压表V的的内阻RV的计算公式,并说明符号的意义:
23.(16分).  如图10所示,水平地面上的一个质量为50kg的木箱中,用轻细绳挂着质量为1kg的小铁球,细绳与铁球构成一个摆长为1m的单摆.用水平向右的推力推箱子,使它向右运动. 已知木箱与地面的摩擦因数为μ=0. 25
如图10所示,水平地面上的一个质量为50kg的木箱中,用轻细绳挂着质量为1kg的小铁球,细绳与铁球构成一个摆长为1m的单摆.用水平向右的推力推箱子,使它向右运动. 已知木箱与地面的摩擦因数为μ=0. 25
(1)若箱子以速度2m/s做匀速运动,摆以很小的摆角完成了10次全振动的过程中箱子的位移多大?
(2)如果水平推力为某值时,摆线稳定地偏离竖直方向37°角相对静止,这种情况下推力多大?(g=10m/s2、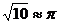 )
)
24.  如图13所示,在光滑的水平面上有一长为L的木板B,上表面粗糙,在其左端有一光滑的1/4圆弧槽C,与长木板接触但不相连,圆弧槽的下端与木板上表面相平,B、C静止在水平面上。现有滑块A以初速V0从右端滑上B,并以1/2 V0滑离B,确好能到达C的最高点。A、B、C的质量均为m,试求:(1)木板B上表面的动摩擦因素μ;(2)1/4圆弧槽C的半径R;(3)当A滑离C时,C的速度。
如图13所示,在光滑的水平面上有一长为L的木板B,上表面粗糙,在其左端有一光滑的1/4圆弧槽C,与长木板接触但不相连,圆弧槽的下端与木板上表面相平,B、C静止在水平面上。现有滑块A以初速V0从右端滑上B,并以1/2 V0滑离B,确好能到达C的最高点。A、B、C的质量均为m,试求:(1)木板B上表面的动摩擦因素μ;(2)1/4圆弧槽C的半径R;(3)当A滑离C时,C的速度。
25. 如图(a)所示的真空管中,电子从灯丝K发出(初速不计),经电压为U1的加速电场加速后沿中心线进入两平行金属板M、N间的匀强电场中,通过电场后打到荧光屏上的P点处,设M、N板间电压为U2,两板距离为d,板长为L1,板右端到荧光屏的距离为L2,已知U1=576V,U2=168V,L1=6cm,d=3cm,L2=21cm,电子的比荷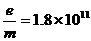 C/kg,求:(1)电子离开偏转电场时的偏角θ(即电子离开偏转电场时速度与进入偏转电场时速度的夹角);
C/kg,求:(1)电子离开偏转电场时的偏角θ(即电子离开偏转电场时速度与进入偏转电场时速度的夹角);
(2)电子打到荧光屏上的位置P偏离荧光屏中心O的距离OP;
 (3)若撤去M、N间的电压U2,而在两平行板中的圆形区域内(如图b所示)加一磁感应强度为B=0.001T的匀强磁场,圆形区域的中心正好就是两平行板空间部分的中心,要使电子通过磁场后仍打在荧光屏上的P点处,圆形区域的半径r为多少?(结果中可含有反三角函数)
(3)若撤去M、N间的电压U2,而在两平行板中的圆形区域内(如图b所示)加一磁感应强度为B=0.001T的匀强磁场,圆形区域的中心正好就是两平行板空间部分的中心,要使电子通过磁场后仍打在荧光屏上的P点处,圆形区域的半径r为多少?(结果中可含有反三角函数)
26.(16分)下图为元素周期表中前四周期的表格
(1)根据要求将相关元素的符号,填入表格中所对应的位置
①A元素的最高价氧化物的水化物碱性最强
②B元素单质在自然界硬度最高
③C元素的氢化物分子组成中有二核18个电子
④D的氢化物与D的高价氧化物的水化物反应生成一种盐
(2)用电子式表示A、C间形成化合物的过程是__________。
(3)甲是一种常见的化合物,化学式为 XCl3
①根据所学知识,将X代表的元素符号填在所给周期表的对应位置中(要求写出2种)
②若将一种XCl3溶液蒸干、灼烧,得到红棕色粉末,则该反应的化学方程式为:
。
③若X代表另一种金属单质,该单质可与②中红色粉末在高温下发生反应,则X元素的原子结构示意图为 ;将等物质的量的A、X的单质投入足量水中,向反应后的溶液中逐滴加入浓度为1 mol/L的盐酸溶液,至100mL时沉淀刚好达到最大值,则投入X的物质的量为
27.(14分)已知A为常见金属单质,X、Y为常见非金属单质,X、E、F、G常温下
为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某
些电池的电解质。现用A和石墨作电极,B的浓液作电解质,构成原电池。有关物质之
间的转化关系如下图(注:其中有些反应的条件及部分生成物质略去)。
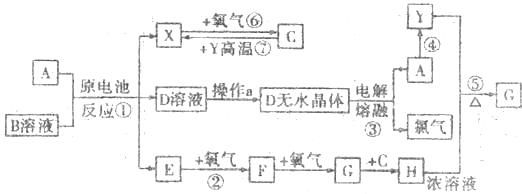
填写下列空白:
(1)反应④为A在某种气体中燃烧,成单质Y和A的氧化物,其反应方程式为
。
(2)反应②的化学方程式为 。
(3)反应⑤的化学方程式为 。
(4)反应③中,电解时阳极的电极反应式为 。
(5)B物质申含有的化学键为 、晶体类型为 、B溶液呈 (填“酸”或“碱”或“中”)性,用离子方程式表示其原因 。
28.(一)(4分)下列有关化学实验的操作或说法中,不正确的是_______________。
A.在粗盐的提纯实验中,溶解、过滤、蒸发等操作中都需要用到玻璃棒。
B.将润湿后的pH试纸置于表面皿上,再用玻璃棒蘸取溶液点在pH试纸的中部,然后与标准比色卡比较,即可测出该溶液的pH。
C.实验时不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗
D.配制FeCl3溶液时,应将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.在250mL烧杯中加入216mL水和24g NaOH固体,溶解并搅拌均匀,即可配得9.6% NaOH溶液
14. 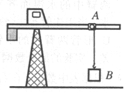 如图所示的塔吊臂上有一可以沿水平方向运动的小车A,小车下装有吊着物体B的吊钩.在小车A与物体B以相同的水平速度沿吊臂方向匀速运动的同时,吊钩将物体B向上吊起,A.B之间的距离以
如图所示的塔吊臂上有一可以沿水平方向运动的小车A,小车下装有吊着物体B的吊钩.在小车A与物体B以相同的水平速度沿吊臂方向匀速运动的同时,吊钩将物体B向上吊起,A.B之间的距离以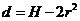 (SI)(SI表示国际单位制,式中H为吊臂离地面的高度)规律变化,则物体做
(SI)(SI表示国际单位制,式中H为吊臂离地面的高度)规律变化,则物体做
A.速度大小不变的曲线运动.
B.速度大小增加的曲线运动.
C.加速度大小方向均不变的曲线运动.
D.加速度大小方向均变化的曲线运动.
15. 下列说法正确的是:
A.卢瑟福通过α粒子散射实验,否定了汤姆生的原子结构模型,提出了原子的核式结构学说。
B.麦克斯韦电磁场理论指出:变化的电场产生变化的磁场,变化的磁场产生变化的电场。
C.受爱因斯坦量子论的启发,普朗克在对光电效应的研究中,提出了光子说。
D.光的干涉、衍射现象证明了光是一种波,但德布罗意的“物质波”假设否定了光是一种波。
16. 对于下列光现象的说法中,正确的是
A.雨后公路上面的油膜出现彩色条纹,这是光的衍射现象
B.太阳光斜射到铁栅栏上,地面出现明暗相间的条纹,这是光的衍射现象
C.光导纤维是利用光的全反射现象制成的
D.位于月球本影区的人,能看到月全食
17. 美国天文学家于2004年3月15日宣布,他们发现了可能成为太阳系第十大行星的以女神“塞德娜”命名的红色天体。如果把该行星的轨道近似为圆轨道,则它绕太阳公转的轨道半径约为地球绕太阳公转轨道半径的470倍,是迄今为止发现的离太阳最远的太阳系行星。该天体半径约为100km,约为地球半径的1/6。由此可以估算出它绕太阳公转的周期最接近
A.15年 B.60年 C.470年 D.104年
18. 根据热力学定律和分子运动理论。可知下列说法中正确的是
A.理想气体在等温变化时,内能不改变,因而与外界不发生热交换
B.布朗运动是液体分子的运动,它说明分子永不停息地做无规则运动
C.物体放出热量,温度不一定降低
D.一定质量的气体,当温度升高时,气体必定从外界吸收热量
19. 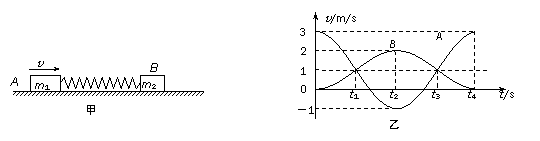 如下图甲所示,一轻弹簧的两端与质量分别为m1和m2的两物块A、B相连接,并静止在光滑的水平面上。现使A瞬间获得水平向右大小为3m/s的速度,从此刻起,两物块的速度随时间变化的规律如下图乙所示,从图象信息可得
如下图甲所示,一轻弹簧的两端与质量分别为m1和m2的两物块A、B相连接,并静止在光滑的水平面上。现使A瞬间获得水平向右大小为3m/s的速度,从此刻起,两物块的速度随时间变化的规律如下图乙所示,从图象信息可得
A.在t1和t3时刻两物块速度相等,均为1m/s,且弹簧都是处于压缩状态
B.从t3到t4时刻弹簧由压缩状态恢复到原长
C.两物体的质量之比为m1∶m2 = 1∶2
D.在t2时刻A与B的动能之比为E k1∶ E k2 =1∶8
20. 如图5所示,电路为演示自感现象的实验电路.实验时,先闭合开关S,稳定后设通过线圈L的电流为Il,通过小灯泡E的电流为I2,小灯泡处于正常发光状态,迅速断开开关S,则可观察到灯泡E闪亮一下后熄灭,在灯E闪亮短暂过程中
如图5所示,电路为演示自感现象的实验电路.实验时,先闭合开关S,稳定后设通过线圈L的电流为Il,通过小灯泡E的电流为I2,小灯泡处于正常发光状态,迅速断开开关S,则可观察到灯泡E闪亮一下后熄灭,在灯E闪亮短暂过程中
A.线圈L中电流I1逐渐减为零
B.线圈L两端a端电势高于b端
C.小灯泡E中电流由Il逐渐减为零,方向与I2相反
D.小灯泡E中电流由I2逐渐减为零,方向不变
21. 如图4所示,在真空中,匀强电场的方向竖直向下,匀强磁场的方向垂直纸面向里。三个油滴a、b、c带有等量的同种电荷,已知a静止,b向右匀速运动,c向左匀速运动.比较它们的质量应有
A.a油滴质量最大 B.b油滴质量最大
C.c油滴质量最大 D.a、b、c的质量一样
第Ⅱ卷(非选择题 共174分)
22(一)(8分). 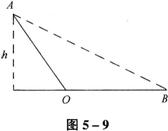 如图5-9所示的器材是:木质轨道(其倾斜部分与水平部分能平滑连接,水平部分足够长)、小铁块、两枚图钉、一条细线、一个量角器,用上述器材测定小铁块与木质轨道间的动摩擦因数μ,实验步骤是:
如图5-9所示的器材是:木质轨道(其倾斜部分与水平部分能平滑连接,水平部分足够长)、小铁块、两枚图钉、一条细线、一个量角器,用上述器材测定小铁块与木质轨道间的动摩擦因数μ,实验步骤是:
(1)将小铁块从____________;
(2)用量角器测量____________;
(3)用图钉把细线____________;
(4)动摩擦因数表示为μ=____________。
13、在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是( )

12.下列排列顺序正确的是
A.稳定性:NH3<PH3<AsH3 B.酸性: H2SO4>H3PO4>H2SiO3
C.还原性: S2- < Br- < Fe2+ D.熔沸点:MgO>H2O>N2>O2
11.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2+ + 2S2O32- + O2 + xOH-=Fe3O4 + S4O62- + 2H2O。下列说法正确的是
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O 都是还原剂
都是还原剂
C.每生成1mol Fe3O4,转移电子数为3mol D.x=2
10.下列离子方程式正确的是
A.将少量的硝酸银溶液滴入氨水中 Ag+ + NH3·H2O = AgOH↓ + NH4+
B.向KI与稀硫酸的混合溶液中通入氧气:2H++O2+2I-===I2+H2O
C.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合
AlO2-+4H+===Al3++2H2O
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
9.下列有关描述一定正确的是
A.常温常压下,17gH2O2中含有的中子数约为16×6.02×1023
B.100mL1.0 mol·L-1Fe(NO3)2溶液和100mL2.0 mol·L-1 HNO3溶液混合后:
c(NO3-)=2.0 mol·L-1
C.pH相等的CH3COONa、NaClO、NaHCO3三种溶液:
c(CH3COONa) > c(NaHCO3) >c(NaClO)
D.已知乙醇和乙烯的燃烧热分别为1366.8 kJ·mol-1和1411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l);△H=+44.2kJ·mol-1
8.2005年1月美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构-Al13和Al14 。A113、A114的性质很象现行周期表中的某主族元素,且Al13和Al14超级原子结构都是具有40个价电子时最稳定。下列说法中,正确的是 : ( )
A. Al14最外层电子数之和为42,与ⅡA族元素原子的性质相似,A113与卤素性质相似
B.Al13超原子中Al原子间通过离子键结合
C.Al13、Al14互为同位素
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
7.用下列实验装置进行的实验中,能达到相应实验目的的是

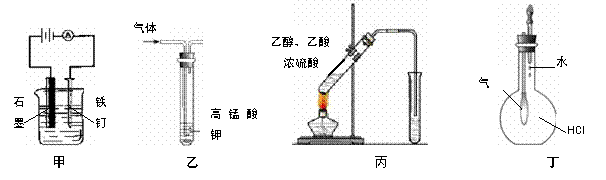
A.装置甲:加快铁钉生锈 B.装置乙:除去乙烯中混有的乙炔
C.装置丙:实验室制取乙酸乙酯 D.装置丁:验证HCl气体在水中的溶解性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com