
题目列表(包括答案和解析)
29.(共13分)
由烃A经下列反应可得到G、H两种高聚物,它们是两种不同性能的塑料。
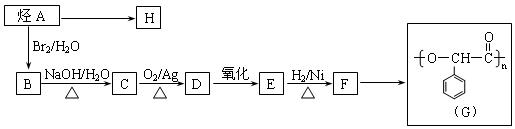
⑴高聚物H的结构简式是_____________。
⑵C转化为D的化学方程式是_________。
⑶A→B的反应类型是__________;F→G的反应类型是__________。
⑷在一定条件下,两分子F能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是____________。
⑸G在热的NaOH溶液中水解的化学方程式是__________。
⑹F的同分异构体有多种,其中既能使FeCl3溶液显色,又能发生水解反应,且每个分子中苯环上只有两个取代基的同分异构体有_______种。
2009届高三模拟考试化学
姓名 学号
28.(共15分)
某课外小组利用乙炔与酸性KMnO4溶液反应,测定乙炔的相对分子质量。下图是测定装置示意图。
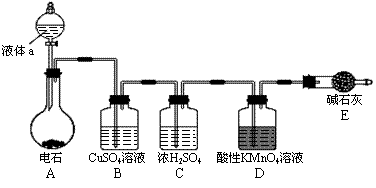
⑴实验室制取乙炔时,分液漏斗中的液体a通常是__________。
⑵CuSO4溶液的作用是__________。
⑶配平乙炔与酸性KMnO4溶液反应的化学方程式(请在方框中填计量系数): □C2H2+□KMnO4+□H2SO4-□K2SO4+□MnSO4+□CO2↑+□H2O
⑷该小组实验如下:实验前,D装置中KMnO4的物质的量为x mol。实验完毕,D及E装置的总质量共增重y g,此时D中过量的KMnO4恰好能与含z mol FeSO4的溶液完全反应(注:反应中MnO4- 被还原成Mn2+,Fe2+被氧化成Fe3+)。则所测乙炔的相对分子质量是(请用含字母x、y、z的代数式表示)__________。
⑸若该小组实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项)__________。
A.装置A中产生的气体直接通入酸性KMnO4溶液
B.乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出
C.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
⑹另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?
答:___________。
27. (15分)
(15分)
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
回答下列问题:
⑴在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是__________。
⑵若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间。则反应①的离子方程式是__________。
⑶若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是__________。
⑷若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生。在加热条件下,当A过量时,反应①的离子方程式是________。
⑸若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素构成,当A过量时,C及D均易溶于水。则A过量时反应①的化学方程式是__________。
26.(15分)
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C为金属元素。A、C同主族,B、D同主族,B的原子序数是D原子序数的一半,A、B原子序数之和比C原子序数少2。
回答下列问题:
⑴D2-离子的结构示意简图是_______________。
⑵用电子式表示A、E间形成化合物的过程是__________。
⑶某金属x在通常情况下呈液态,常温常压下,x能被B的某单质y氧化(同时有另一种单质生成),则x与y反应的化学方程式是__________。
⑷在某种工业生产中,只含B、D两元素的重要反应是__________。
⑸某盐z由上述五种元素中的某几种元素组成,已知z的水溶液显碱性。若将z的水溶液长期露置于室外空气中,最终溶液呈中性。用离子方程式表示盐z的水溶液显碱性的原因是__________。
13.用惰性电极电解CuSO4溶液,一段时间后取出电极。向电解后的溶液中加入9.8g的Cu(OH)2,充分反应后所得溶液与电解前相同,则电解时电路中通过电子的物质的量是
A.0.4mol B.0.3mol C.0.2mol D.0.1mol
12.火箭推进器中盛有液态肼(N2H4)和液态双氧水,当它们混合时,立即产生氮气和水蒸气,并放出大量的热。已知6.4g液态肼与足量的液态双氧水反应生成氮气和水蒸气时,放出128.326kJ的热量。下列热化学式正确的是
A.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=+128.326kJ/mol
B.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-128.326kJ/mol
C.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-641.63kJ/mol
D.N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-256.625kJ/mol
11.乙酸橙花酯是一种食用香料,结构如图所示。下列关于该有机物的说法有如下几种:
 ①该有机物有一种同分异构体属于酚类;
①该有机物有一种同分异构体属于酚类;
②该有机物属于酯类;
③该有机物不能发生银镜反应;
④该有机物的分子式为C11H18O2;
⑤1mol该有机物最多能与2mol NaOH反应。
其中正确的是
A.①③④ B.②③⑤ C.①④⑤ D.①③⑤
10.常温下,下列溶液中各离子浓度关系正确的是
A.浓度为0.01mol/L的FeCl3溶液: c(Cl-)=3c(Fe3+)
B.浓度为0.1mol/L的碳酸钠溶液: c(Na+)+c(H+)=2c(CO32-)+c(OH-)
C.pH=12的氨水溶液与pH=2的盐酸等体积混合: c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.醋酸溶液与NaOH溶液相混后,所得溶液呈中性: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
9.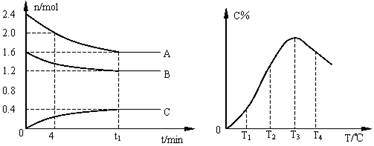 在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系。某温度下,A、B、C三者物质的量与时间的关系如下左图所示,而C的百分含量与温度的关系如下右图所示。
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系。某温度下,A、B、C三者物质的量与时间的关系如下左图所示,而C的百分含量与温度的关系如下右图所示。
下列说法错误的是:
A.0-4分钟时,A的平均反应速率为0.01mol/(L·min)
B.由T1向T2变化时,V正>V逆
C.此反应的正反应为吸热反应
D.其它条件不变时给平衡体系加压,达新平衡时,C的体积分数增大
8.下列离子方程式书写正确的是
A.氧化铜与稀硫酸:O2-+2H+=H2O
B.碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
C.Fe3O4溶于过量的稀HNO3:Fe3O4+8H+=2Fe3++Fe2++4H2O
D.少量的NaHCO3溶液与过量的Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com