
题目列表(包括答案和解析)
1.右图表示生活在同一自然区域内的部分生物,对图中各生物关系的分析合理的是( )
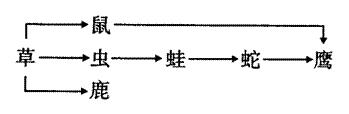
A.若蛇种群的年龄组成为增长型,则鹰种群密度可能增大
B.该食物网构成一个生物群落
C.鹰和鹿存在着地理隔离和生殖隔离
D.图中虫获得的能量占草能量的10%一20%
35.(8分)[物理一物理3-5]
质量为m1的42He核,以速度V0轰击质量为m2的静止的l2N核,发生了核反应,最终产生两种新粒子A和B。其中A为128O核,质量为m3,速度为V3;B的质量为m4。
(1)写出核反应方程式;
(2)计算粒子B的速度VB;
(3)粒子A的速度符合什么条件时,粒子B的速度方向与He核的运动方向相反。
34.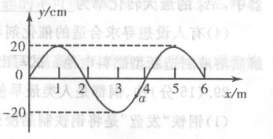 (8分)[物理一物理3-4]
(8分)[物理一物理3-4]
沿z轴正方向传播的一列简谐横波在某时刻的波形图如
图所示,其波速为200 m/s。则
(1)图示时刻质点a的速度方向如何?
(2)若此波遇到另一简谐波能发生稳定的干涉现象,求
所遇到波的频率。
(3)质点a在此后的1 s内通过的路程为多少?
33.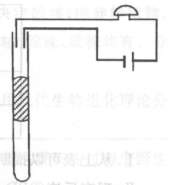 (8分)[物理一物理3-3]
(8分)[物理一物理3-3]
如图所示为一简易火灾报警装置。其原理是:竖直放置的试管中装有
水银,当温度升高时,水银柱上升,使电路导通,蜂鸣器发出报警的响声。
27℃时,空气柱长度L1为20cm,水银上表面与导线下端的距离L2为
10 cm,管内水银柱的高度h为8cm,大气压强为75cm水银柱高。
(1)当温度达到多少℃时,报警器会报警?
(2)若水银柱上升过程中,被封闭气体吸收热量9×10-2J,对外做功
6×10-2J,求封闭气体内能的变化量。
(3)如果大气压增大,则该报警器的报警温度会怎样变化?
32.(8分)[生物一现代生物科技专题]
下面是畜牧业生产上培育某种优良种牛的两种方法,请分析回答:

(1)方法I和方法II均用到的生物技术有 和 。
(2)用激素处理的目的是使B牛--,从B牛体内获得的卵细胞需要培养
到--(时期)才能与精子结合。
(3)A牛的精子必须在B牛的生殖道中经过相应的生理变化后,才能与B牛的卵细胞结合,完成受精作用,这个过程叫 。卵子受精的标志是在卵黄膜和透明带的间隙能
够观察到 。
(4)生产上常用 期的胚胎进行胚胎移植。若希望同时获得多个性状相同的家畜个体,可以使用 技术
31.(8分)[化学一有机化学基础]
已知醛在一定条件下可以发生如下转化:


 RCH2CHO+R’CH2CHO
RCH2CHO+R’CH2CHO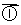 RCH2 -CH - CHCHO
RCH2 -CH - CHCHO RCH2CH===CCHO
RCH2CH===CCHO
OH R’ R’
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题:

(1)A中所含的官能团是(填写名称) ,B的结构简式是 。
(2)EÒF的反应类型是 。(填字母代号)
a.还原反应 b.加成反应 c.取代反应 d.消去反应
(3)G、D反应生成H的化学方程式是:
(4)G有多种同分异构体,其中能与金属钠反应生成氢气且苯环上只有一个取代基的回分异构体有 种(不包括G)。
30.(14分)化学科研小组的同学在测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验进一步探究,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L1的H2SO3溶液的pH约为2。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1 molL-1的H2S溶液的pH约为4。
[实验操作]①准确称取纯净的Na2SO3·7 H20晶体25.2 g,配成1 L水溶液,测得其pH约为8。
②用坩埚再次准确称取25.2 g上述晶体,继而隔绝空气在6000C以上高温下强热至恒重,固体质量为12.6 g。
③将②所得12.6 g固体进行元素定性定量分析,其组成与Na2SO3完全相同。将其溶于水配成250 mL溶液,测得pH约为1l。
[分析猜想]Na2SO3·7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)在测定溶液pH的实验操作过程中,下列做法正确的是 (填字母代号)
a.先将pH试纸湿润后,再用玻璃棒蘸取待测液点到pH试纸上
b.直接将pH试纸插入待测液中
C.用玻璃棒蘸取待测液点到pH试纸上
d.先将pH试纸用蒸馏水粘到玻璃片上,再用玻璃棒蘸取待测液点到pH试纸上
(2)给Na2SO3·7H2O加热时要隔绝空气,请用简要的文字和化学方程式给以说明:
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是:
(不必配平)。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
,实验③中溶液的pH约为11的原 理是(以相关的离子方程式表示) 。
(5)请你设计简单的实验方案,以验证你的猜想(请简要写出实验步骤、现象和结论):
[选做部分]
共5小题。考生从中选择2个物理、1个化学和1个生物题目作答。
29.(15分)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛。
(1)钢铁“发蓝,,是将钢铁制品浸到某些氧化性的溶液中,使其表面形成一层四氧化三铁的技术过程。其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到1300C反.应。其过程可以用如下化学方程式表示:
I 3Fe+NaN02+5NaOH=3Na2FeO2+H20+NH3Ó
II 6Na2Fe02+NaN02+5H2O=3 Na2Fe204+NH3十+7NaOHÓ
ⅢNa2Fe02+Na2Fe2O4+2H20=Fe304+4NaOH
①反应II中的氧化剂是 。整个反应过程中每有16.8g Fe参加反应转移的电子数
为 NA。
②上述反应过程中会产生大量NH3。下列对NH3处理方案中合理的是--(填字母
代号)
a.高空排放
b.用H2SO4吸收制氮肥
C.用于制备HNO3
(2)研究金属活动性顺序可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀
铜制电路板。
①请根据金属活动性顺序及该反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序为
_________________________。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
实验方案及现象:
(3)如下图,横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5 mol·L-1时,可认为沉淀完全)。试回答下列问题

①腐蚀铜板后的溶液中,若Cu2+Fe3+和Fe2+浓度均为0.1 mol·L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2] 。
28.(13分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A元素原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,A、B、c三种元素都能与D元素形成两种或两种以上原子个数比不相同的常见化合物。E为常见金属元素,它与同主族下一周期元素的原子序数之差为18。试回答下列问题:
(1)均由A、C、D三种元素组成的不同类别的三种常见物质,当它们的水溶液浓度相同时,由水电离出的c(H+)由小到大的顺序为(填化学式): 。
(2)A与D可形成负一价双原子阴离子,请写出E的单质与过量该阴离子的水溶液反应的离
子方程式一。
(3)设反应①Fe(s)+BD2(g) FeD(s)+BD(g)
△H1其平衡常数为K1。
FeD(s)+BD(g)
△H1其平衡常数为K1。
反应2Fe(s)+A2D(g) FeD(s)+A2(g) △H2,其平衡常数为K2 。
FeD(s)+A2(g) △H2,其平衡常数为K2 。
在不同温度下,K1、K2的值如下:
|
温度 |
K1 |
K2 |
|
973K |
1.47 |
2.38 |
|
TK |
1.87 |
1.87 |
|
1173K |
2.15 |
1.67 |
I.从上表可以推断:△H2 0(填“>”或“<”)。
Ⅱ.现有反应③BD2(g)十A2(g)  BD(g)+A2D(g) △H3,其平衡常数为K3,则K2的值为
(用K1、K2表示)。若在TK时,将2mol的BD2(g)和1 moIlA2(g)放人1L密闭容器中,A2的最大转化率为
。
BD(g)+A2D(g) △H3,其平衡常数为K3,则K2的值为
(用K1、K2表示)。若在TK时,将2mol的BD2(g)和1 moIlA2(g)放人1L密闭容器中,A2的最大转化率为
。
(4)有人设想寻求合适的催化剂和电极材料,以A2、C2为电极反应物,以HCl一NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式 。
27.(16分)石刁柏(嫩茎俗称芦笋)是一种名贵的蔬菜,为XY型性别决定的雌、雄异株植物。野生型石刁柏(纯合体)叶窄产量低。在某野生种群中发现了几株阔叶石刁柏,雌株、雄株均有。分析回答:
(1)野生型石刁柏种群历经百年,窄叶基因频率由98%变为不到10%,用现代生物进化理论分析其原因是
在这漫长的过程中野生型石刁柏并没有形成新的物种,是因为 。
(2)阔叶型的出现可能是由于环境改变引起的。在实验田中,选用阔叶石刁柏雌、雄株杂交,若杂交后代全部为 ,则是由于环境改变引起的不可遗传的变异;若杂交后代出现 ,则可能是可遗传的变异。
(3)同为阔叶型石刁柏,其雄株的产量与质量都超过雌株,请从提高经济效益的角度,运用遗传学原理设计育种方案。

(4)有若干具有某相对性状的雌雄石刁柏,其中雌株为隐性纯合体、雄株为显性纯合体(注;XAY、XaY均视为纯合),控制该性状的基因可能位于常染色体上或X染色体的特有区段(如图Ⅱ-2区段)或X、Y染色体的同源区段(如图I区段),请补充下列实验方案以确定该基因的位置。
取若干雌、雄石刁柏种植,若杂交后代中,
,则该基因位于X染色体的特有区段a若后
代中无论雌、雄株均为显性,则再选取后代中雌、雄株进行杂交,若后代中
,则该基因位于常染色体上,若
,则该基因位于X、Y染色体的同源区段。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com