
题目列表(包括答案和解析)
1.下图为处于不同分裂时期的某生物的细胞示意图,下列叙述正确的是
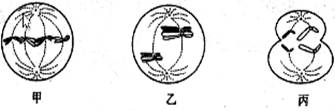
A.甲、乙、丙中都有同源染色体 B.卵巢中不可能同时出现这三种细胞
C.能够出现基因重组的是乙 D.丙的子细胞是精细胞
32.[生物-现代生物技术专题](10分)
为扩大可耕地面积,增加粮食产量,黄河三角洲等盐碱地的开发利用备受关注。我国科学家应用耐盐基因培育出了耐盐水稻新品系。
(1)获得耐盐基因后,构建重组DNA分子所用的限制性内切酶作用于图中的 处,DNA连接酶作用于 处。(填“a”或“b”)
(2) 将重组DNA分子导入水稻受体细胞的常用方法有农杆菌转化法
和 法。
(3)由导入目的基因的水稻细胞培养成植株需要
利用 技术。
 (4)为了确定耐盐转基因水稻是否培育成功,既要用放射性同位素标记的
作探针进行分子杂交检测,又要用
方法从个体水平鉴定水稻植株的耐盐性。
(4)为了确定耐盐转基因水稻是否培育成功,既要用放射性同位素标记的
作探针进行分子杂交检测,又要用
方法从个体水平鉴定水稻植株的耐盐性。
30.[化学选考-----物质结构与性质](13分)
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)配合物分子内的作用力有 (填编号)。
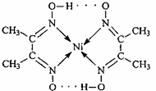
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
 (3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
 ①CH2=CH2、②CH≡CH、③
、④HCHO等,
①CH2=CH2、②CH≡CH、③
、④HCHO等,
其中分子属于平面结构的有 (填物质序号),
预测HCHO分子的立体结构为 形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为 。
29.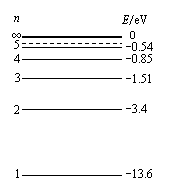 (物理--选修3-5)本题共有两小题,每小题6分,共12分。每小题给出的四个选项中,只有一项是符合题目要求的。
(物理--选修3-5)本题共有两小题,每小题6分,共12分。每小题给出的四个选项中,只有一项是符合题目要求的。
(1)如图所示是氢原子的能级图.若一群处于n=3激发态的氢原子跃迁到n=2激发态时发射出的是红光,则这群处于n=3激发态的氢原子发生跃迁还可能发射出
A.紫外线
B.红外线
C.β射线
D.γ射线
(2)质量为2m的B球静止放于光滑水平面上,另一质量为m的A球以速度v与B球正碰,如图所示,若碰撞过程没有能量损失,则碰后A球的速度为
 A.
A. B.
B.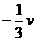
C. D.
D.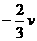
28.
27.(15分)下图是科学家对果蝇一条染色体上的基因测序结果,请看图回答问题:

(1)图中朱红眼与深红眼两个基因是________(供选:A.等位基因 B.非等位基因),遗传时二者之间是否遵循基因的分离定律和自由组合定律?________(供选:A.不遵循 B.遵循 C.只遵循分离定律 D.只遵循自由组合定律)。该染色体上的基因在后代中能否全部表达?_______________________,原因是______________________________。
(2)计算此染色体上的碱基数量,是否遵循A=T,C=G的原则?___________。原因是______________________________
(3)假定朱红眼的基因共有30个碱基对,则其控制合成的肽链中所含氨基酸数为____。
A.10个 B.20个
C.少于10个 D.多于20个
26.(25分)回答下列Ⅰ、Ⅱ题:
Ⅰ .在科学研究中常用呼吸商(RQ=释放的二氧化碳体积/消耗的氧体积
.在科学研究中常用呼吸商(RQ=释放的二氧化碳体积/消耗的氧体积
)
 表示生物用于有氧呼吸的能源物 质不同。测定发芽种子呼吸商的装置如下图.
表示生物用于有氧呼吸的能源物 质不同。测定发芽种子呼吸商的装置如下图.
2-28题图
关闭活塞,在25℃下经20分钟读出刻度管中着色液移动距离。设装置1和装置2的着色液分别向左移动x和y(mm)。x和y值反映了容器内气体体积的减少。 请回答:
(1)装置1的小瓶中加入NaOH溶液的目的是
(2)x代表 值,y代表 值。
(3)若测得x=200mm,y=30(mm),则该发芽种子的呼吸商是
(4)若要测定已长出一片真叶幼苗的RQ值,则应将该装 置放于何种条件下进行,为什么?
(5)为使测得x和y值更精确,还应再设置一对照装置。对照装置的容器和小瓶中应分别放入 。设 对照的目的是 。
Ⅱ.为了验证某大豆品种的矮化特性与赤霉素的含量有关,请用所给的实验材料,完成下列实验步骤并回答下列问题:
实验材料:具2片真叶且长势相同的该品种大豆幼苗若干、完全培养液、蒸馏水、适宜浓度的赤霉素溶液,喷壶等。
(1)实验步骤:
①将上述大豆幼苗平均分成A、B两组,A组为对照组,B组为实验组,分别置于等量的完全培养液中培养。
②用喷壶分别将 和 喷洒在A、B两组幼苗上。
③将两组苗置于相同且适宜的温度和光照等条件下培养,一段时间后,测定两组植株的 。
(2)预测实验结果: 。
(3)上述实验中,如果A、B两组各选用1株幼苗进行实验,是否影响实验结果的可靠性?为什么?
(4)该实验原理是:
。
25. (16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1) 已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定 (填序号)。
① 含Fe2+,不含Fe3+② 含Fe3+,不含Br-③ 含Fe3+,含有Br-
(2) 773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。

① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g)ΔH>-91 kJ·mol-1
CH3OH(g)ΔH>-91 kJ·mol-1
 b. 使用催化剂, 能够提高反应物转化率
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
(3) 高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作极 (填“阴”或“阳”);
② Ni电极的电极反应式
为: 。
(4) 氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO-3+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的 (填化学式)能使上述还原过程发生。
24. (16分)化学实验是研究物质性质的基础。
(1) 下列有关实验操作或测量数据合理的是 (填序号)。
a. 用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b. 用干燥的pH试纸测定浓硫酸的pH
c. 用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2) 某废水样品中含有一定量的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:
试剂X从下列试剂中选择:
a. 0.1 mol·L-1KMnO4(H2SO4酸化)溶液b. 0.5 mol·L-1NaOH溶液
c. 新制氯水d. KI溶液
① 加入试剂X后生成SO42-的离子方程式为 ;
② 甲组方案中,第ⅲ步的“系列操作”包含的操作名称为 、 ;
乙组方案:
ⅰ. 用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ⅱ. 精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定;(有关反应为:2MnO4-+5SO32-+6H-=2Mn2++5SO42-+3H2O)
ⅲ. 记录数据,计算。
③ 乙组设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。
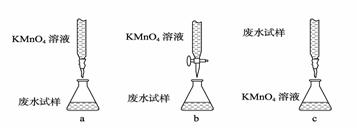
(3) 某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加1 mol·L-1的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 。
(4) 用下图装置进行CO2性质的有关实验。
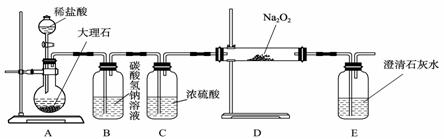
① 试剂瓶B中盛有饱和NaHCO3溶液,其目的是 ;
② 反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
23. (14分)氮元素是生命活动、物质间转化的常见元素。

(1) 图a是元素周期表中N元素的有关信息,图a中横线上缺失的信息是 。15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2) “三鹿”奶粉中含有超标的三聚氰胺引起了人们对食品安全的极大关注。三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,
正确的是 (填字母序号)。
a. 属于蛋白质b. 是氨基酸c. 是食品添加剂d. 和氨基酸含有相同种类的原子团e. 属于高分子化合物
(3) 如上图c装置,将灼热的铂丝伸入锥形瓶中,同时通过导管鼓入空气,发现在锥形瓶口有少量的红棕色气体生成。写出导致该现象的主要化学方程式: 、
。
(4) 金属与不同浓度的硝酸反应时,往往生成多种不同价态的还原产物。图d是各种不同密度的硝酸与铁反应时(相同温度)还原产物的分布图。
① 某硝酸试剂瓶的标签注明:密度1.26 g·mL-1,质量分数 50.0%;若取该试剂10 mL配成1 000 mL溶液,所得溶液的pH= 。
 ② 当硝酸溶液的密度为1.36 g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是
(填序号)
② 当硝酸溶液的密度为1.36 g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是
(填序号)
a. 2Fe+10HNO32=Fe(NO3)3+NO↑+3NO2↑+5H2O
b. 4Fe+18HNO3=4Fe(NO3)3+3NO↑+3NO2↑+9H2O
c. 2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com