
题目列表(包括答案和解析)
31.(化学——有机化学基础,13分)
丙烯是重要的工业原料,以丙烯为原料合成有机玻璃和药物喹啉的流程如下:

回答下列问题:
(1)结构简式A为 ,C为 ;
(2)①-⑩反应中属于属于消去反应的有 ;
(3)设计反应①、②的目的是 ;
(4)D的同分异构体E能进行银镜反应,分子中有两种不同化学环境的氢原子,其个数比为2∶1,则E的结构简式为 ;
(5)反应⑦的化学反应类型是 。
30.(化学——物质结构与性质,13分)
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化下由F2和过量NH3反应得到。则NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co[(N3)(NH3)5]SO4、(Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。Co[(N3)(NH3)5]SO4中钴的配位数为 。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是 (填“极性”、“非极性”)分子。
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
 A.NaN3与HN3结构类似,都存在N3-离子
A.NaN3与HN3结构类似,都存在N3-离子
B.第一电离能(I1):N>P>S
C.钠晶胞结构如右图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性小
29.[物理--选修3-5](本题共两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)甲、乙两车相向运动,碰撞后一同沿乙车的方向运动,这是因为______。(填选项前的编号)
① 乙车的质量比甲车的大
② 乙车的速度比甲车的大
③ 乙车的动量比甲车的大
④ 乙对甲的作用力大于甲对乙的作用力
(2)质子和中子的质量分别为 和
和 ,当这两种核子结合成氘核时,并以
,当这两种核子结合成氘核时,并以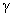 射线的形式放出能量E。已知普朗克常量为
射线的形式放出能量E。已知普朗克常量为 ,真空中的光速为
,真空中的光速为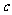 ,
, 则氘核的质量和
则氘核的质量和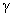 射线的周期的表达式分别为 (填代号)
射线的周期的表达式分别为 (填代号)
①.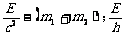 ②.
②.
③. ④.
④.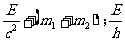
28.[物理--选修3-3](本题共两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)根据下面哪组数据可算出阿伏加德罗常数的是____。(填选项前的编号)
① 水的密度和水的摩尔质量 ② 水分子的质量和水的摩尔质量
③ 水分子的体积和水分子的质量 ④ 水的摩尔质量和水分子的体积
(2)在温度均匀且恒定的水池中,有一小气泡正在缓慢向上浮起,体积逐渐膨胀,在气泡上浮的过程中,气泡内的气体______。(填选项前的编号)
① 向外界放出热量
② 与外界不发生热传递,其内能不变
③ 对外界做功,其内能减少
④ 对外界做功,同时从水中吸收热量,其内能不变
27.(15分)
回答小麦遗传育种的有关问题:
(1)小麦是自花授粉植物,为使小麦产量、品质、抗性等性状在个体间、年度间表现一致,可以从麦田留种繁殖,因为组成小麦某一品种的所有植株都是 。通过自交产生的后代,其性状表现 。
(2)让光颖、抗锈、无芒(ddRRAA)小麦和毛颖、感锈、有芒(DDrraa)小麦杂交(三对相对性状自由组合),得F1,F1自交得F2。若要从F2自交的后代F3中选出毛颖、抗锈、无芒(DDRRAA)的小麦10株,则在F2群体中至少应选择表现型为毛颖、抗锈、无芒(D_R_A_)小麦 株。 ,
(3)若只考虑小麦的无芒(A)和有芒(a)一对相对性状,则小麦三倍体的基因型有 。
(4)在小麦的一个野生群体X中,如果抗锈病和感染锈病这对相对性状的显隐性未知,发现抗锈病对感染锈病的性状表现比例是3∶1,这是否说明抗锈病是显性的(假设这对相对性状是由一对等位基因引起的)?为什么? 。
选考部分
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30 、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案填写在答题卡选答区域的指定位置上。
26.(25分)
I.“漳州水仙花”及其图案是我国第二个花卉类驰名商标,是我国人民春节时最喜欢的室内陈设的花卉之一。为了研究人工合成的生长素类似物a-萘乙酸(NAA)是否对植物的开花具有影响,某研究小组以水仙鳞茎为实验材料进行探究。请根据所给的材料,完成实验设计的思路。
实验材料:品种、大小一致水仙鳞茎20个,0.1mg/mL的NAA溶液适量。
实验设计的思路:
(1)材料处理:需要先剥去水仙鳞茎部分鳞片叶;
(2)实验组(A组)为 ;
(3)对照组(B组)为 ;
(4)因变量为 ;
(5)无关变量有 (写出2点)。
(6)最可能的实验结果和结论: 。
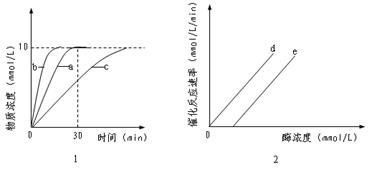 Ⅱ.动物脑组织中含有丰富的谷氨酸脱羧酶,能专一催化1mol谷氨酸分解为1mol γ—氨基丁酸和1molCO2。某科研小组从小鼠的脑中得到该酶后,对该酶的催化反应过程进行研究,结果见下图1和图2。
Ⅱ.动物脑组织中含有丰富的谷氨酸脱羧酶,能专一催化1mol谷氨酸分解为1mol γ—氨基丁酸和1molCO2。某科研小组从小鼠的脑中得到该酶后,对该酶的催化反应过程进行研究,结果见下图1和图2。
(1)图1中的a是在谷氨酸起始浓度为10mmol/L、最适温度、最适pH值、酶浓度固定的条件下得到的曲线。请给该曲线拟定一个合理的名称 。b、c两曲线是通过改变温度、酸碱度或酶浓度得到的曲线,图1中曲线b产生的可能原因是 ;30min后a曲线不再上升的原因可能是 。
(2)图2是在反应物浓度过量添加下,酶催化反应速率随酶浓度变化曲线。图2中曲线e是在谷氨酸脱羧酶和谷氨酸混合溶液中加入一定量的汞离子后,得到的酶催化反应速率随酶浓度变化的曲线(汞离子能与谷氨酸脱羧酸按比例牢固结合不可解离,迅速使酶失活)。你认为出现这种现象的最可能原因是: 使一定量的酶失活,当加入的酶量 后,继续加入的酶开始表现酶活力,此时酶的催化反应速率与酶浓度变化的直线关系不变。
25.(15分)
铁在冷的浓硫酸中能发生钝化。某兴趣小组同学发现将一定量的铁与浓硫酸加热时,铁完全溶解,得到溶液A,并产生大量气体B。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分,并将有关实验操作、预期现象和结论填入下列表格中。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
Ⅲ.任意写出一个铁与浓硫酸加热时,可能发生的有关反应方程式
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量溶液A,滴入0.01 mol/L 酸性KMnO4溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体B通入如下图装置 |
|
含有两种气体 |
 [问题讨论]
[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价:
。
24.(15分)减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的,利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
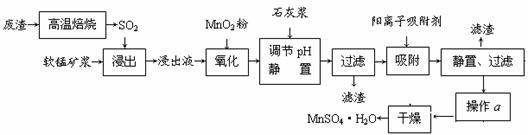
 浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、 Pb2+等其他金属离子。(提示:①在工业上,用沉淀法不能完全除去的离子还可以用 吸附法除去②有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表③阳离子 吸附剂吸附金属离子的效果见下图。 ④已知PbO2的氧化性大于MnO2。)
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、 Pb2+等其他金属离子。(提示:①在工业上,用沉淀法不能完全除去的离子还可以用 吸附法除去②有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表③阳离子 吸附剂吸附金属离子的效果见下图。 ④已知PbO2的氧化性大于MnO2。)
|
离子 |
离子半径(pm) |
开始沉淀pH |
完全沉淀pH |
|
Fe2+ |
74 |
7.6 |
9.7 |
|
Fe3+ |
64 |
2.7 |
3.7 |
|
Al3+ |
50 |
3.8 |
4.7 |
|
Mn2+ |
80 |
8.3 |
9.8 |
|
Pb2+ |
121 |
8.0 |
8.8 |
|
Ca2+ |
99 |
- |
- |
请回答下列问题:
(1)写出浸出过程中主要反应的一个化学反应方程式 , 氧化过程中主要反应的一个离子反应方程式 。
(2)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
(3)决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
(4)操作a包括 过滤、洗涤等过程。
23. (15分) A、B、C、D为四种短周期元素,A、B、D的原子序数和原子半径均依次增大, B、D同主族且能组成一种能形成“酸雨”的化合物。A、B可以形成A2B和A2B2的两种通常情况下呈液态的共价化合物;B、C形成的两种离子化合物溶于水,所得的溶液均呈强碱性;C的单质常温下可与A2B剧烈反应。试回答下列问题:
(1)B、C两元素以微粒个数比1︰1形成的化合物X中,阴、阳离子个数比为______。
(2) 在A2B2作用下,铜与稀硫酸制硫酸铜的化学反应的化学方程为:
____________________________________________________________。
(3) 表示形成DB2 型“酸雨”的化学反应方程式有多个,请你选择一个合适的反应, 写出这个反应的平衡常数表达式K=____________________________
(4) 已知常温下17g A、D两元素组成的化合物与足量的DB2完全反应时放出热量为a kJ,则该反应的热化学方程式为___________________________________。
(5)已知25℃时, Ksp(CaCO3)=1×10-9。Ksp(CaSO4)=9×10-6。长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4 转化为CaCO3的离子方程式为
②请分析CaSO4 转化为CaCO3的原理 。
22.(20分)
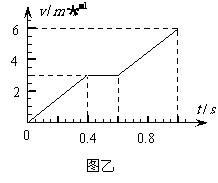
如下图甲所示,两根质量均为 0.1 kg完全相同的导体棒a、b,用绝缘轻杆相连置于由金属导轨PQ、MN架设的斜面上。已知斜面倾角θ为53°,a、b导体棒的间距是PQ、MN导轨间间距的一半,导轨间分界线OO′ 以下有方向垂直斜面向上的匀强磁场。当 a、b导体棒沿导轨下滑时,其下滑速度v与时间的关系图像如图乙所示。若a、b导 体棒接入电路的电阻均为1Ω,其它电阻不计,取g = 10 m/s2,sin53°≈0.8,cos53°≈0.6,试求:
(1)PQ、MN导轨的间距d;
(2)a、b导体棒与导轨间的动摩擦因数;
(3)匀强磁场的磁感应强度。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com