
题目列表(包括答案和解析)
5. 下图表示单位面积放牧量与生产者的净生产量(生产者净生产量是指其同化量减去呼吸消耗量)的关系,虚线表示未放牧时草原中生产者的净生产量,下列有关说法正确的是 ( )
下图表示单位面积放牧量与生产者的净生产量(生产者净生产量是指其同化量减去呼吸消耗量)的关系,虚线表示未放牧时草原中生产者的净生产量,下列有关说法正确的是 ( )
A.草原生态系统营养结构简单,稳定性弱于森林生态系统
B.适度放牧可以促进生产者的净生产量增加
C.适度放牧可以使生产者同化量中的大部分流向放养的牲畜.从而获得最大收益
D.E点所对应的放牧量为该草原的最大控制放牧量
4.下图表示几种含氮物质之间相互转化的关系,下列依据此图的表述中正确的是 ( )

A.⑤⑦是异化作用的过程,⑥⑧是同化作用的过程
B.完成③过程的生物在生态系统中的地位属于消费者
C.土壤疏松可促进④过程,氧气不足可抑制②过程
D.部分细菌、放线菌、蓝藻可以完成①过程,它们的细胞结构均没有核膜
3.细胞的结构与其功能相适应,下列说法不正确的是 ( )
 A.哺乳动物成熟的红细胞依靠无氧呼吸获得能量
A.哺乳动物成熟的红细胞依靠无氧呼吸获得能量
B.蛔虫细胞中无线粒体,在其细胞质中有转录、翻译及C6H12O6 2C3H6O3+能量等生理过程
C.蓝藻和绿硫细菌细胞内都含有色素,都能进行光合作用
D.人体皮肤细胞中,线粒体的数量少于肝细胞,因为皮肤细胞的基因总数少于肝细胞
 1.下图是验证呼吸作用产生二氧化碳的实验装置,在透明的容器B中放入湿润的种子。
1.下图是验证呼吸作用产生二氧化碳的实验装置,在透明的容器B中放入湿润的种子。
以下说法中正确的是( )
A.种子不进行光合作用,检测到的二氧化碳是呼吸作用产生的
B.在光照条件下,澄清石灰水不会变混浊
C.在黑暗条件下,种子也进行呼吸作用
D.光照条件下若澄清石灰水变混浊,是因为光照下种子在单位时间内光合作用消耗的二氧化碳少于呼吸作用产生的二氧化碳
2.利用细胞工程方法,以SARS病毒核衣壳蛋白为抗原制备出单克隆抗体。下列相关叙述正确的是( )
A.用纯化的核衣蛋白反复注射到小鼠体内,产生的血清抗体为单克隆抗体
B.体外培养单个效应B细胞可以获得大量针对SARS病毒的单克隆抗体
C.将等量效应B细胞和骨髓瘤细胞混合,经PEG诱导融合后的细胞均为杂交瘤细胞
D.利用该单克性隆体与SARS抗原特异性抗原决定簇结合的方法可诊断出病毒感染者
32. (10分,每空2分) 如图为两个种间植物细胞融合和再生植株示意图。请据图回答:(一-八表示各主要步骤)
(10分,每空2分) 如图为两个种间植物细胞融合和再生植株示意图。请据图回答:(一-八表示各主要步骤)
(1)从步骤一到步骤二是植物细胞形成原生质体的阶段,其关键技术是 。
(2)从步骤二到步骤三一般要用 作为促融剂。
(3)步骤四为 过程。
(4)步骤八表示选择体细胞杂种植株,杂种植株在形态上表现为同时具有有两个亲本的特性,其根本原因是
。
(5)该项研究解决了育种过程中的什么问题?
。
清流一中2008-2009学年下学期高三理科综合能力试题[2]
成绩:物理 化学 生物 总分
第I卷(选择题)
|
第II卷(非选择题)
|
||
 |
|
|
|
第III卷(选作题)
|
29.(物理-选修3-5)
(1) 铀核  U衰变为铅核
U衰变为铅核
 Pb的过程中,要经过x次α衰变和y次β衰变,其中[ ]①.x=6,y=8 ②.x=8,y=6
Pb的过程中,要经过x次α衰变和y次β衰变,其中[ ]①.x=6,y=8 ②.x=8,y=6
③.x=16,y=22 ④.x=22,y=16
(2)一个质量为60kg的男孩从高处跳下,以5m/s的速度竖直落地,落地时曲膝,用了1s停下来,则落地时受到的平均作用力为[ ]
① 300N 竖直向上 ② 600N 竖直向上
③ 600N 竖直向下 ④ 900N 竖直向上
30,(1)图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。
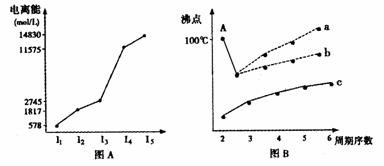
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是a还是b?并说出理由: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
 II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
其中以+4价的Ti最为稳定;
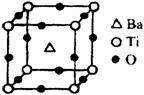
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。
。
则绿色晶体配合物的化学式为 。
31, 已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:


 +H2O某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。
+H2O某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。

(1)CH3COOOH称为过氧乙酸,写出它的一种用途 。
(2)写出B+E→CH3COOOH+H2O的化学方程式 。
(3)写出F可能的结构简式 。
(4)写出A的结构简式 。
(5)1摩尔C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比是 。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式: 。
28.(物理-选修3-3)(1)夏天,如果自行车内胎充气过足,在阳光下爆晒很容易“爆胎”。“爆胎”前内胎容积视为不变,则下列说法中正确的是________。(填选项前的编号)
①“爆胎”前随着温度升高,车胎内气体压强将增大
②“爆胎”前随着温度升高,车胎内气体将向外放出热量
③“爆胎”是车胎所有气体分子的动能都急剧增大造成的
④“爆胎”是车胎内气体分子间斥力急剧增大造成的
(2)某同学家一台新电冰箱能显示冷藏室内的温度。存放食物之前,该同学关闭冰箱密封门并给冰箱通电。若大气压为1.0×10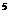
 ,刚通电时显示温度为27℃,通电一段时间后显示温度为6℃,则此时冷藏室中气体的压强是______。(填选项前的编号)
,刚通电时显示温度为27℃,通电一段时间后显示温度为6℃,则此时冷藏室中气体的压强是______。(填选项前的编号)
① ②
② ③
③ ④
④
27.(14分,每空2分)多指为一种常染色体显性遗传病,受P基因控制;色盲是一种X染色体的隐性基因控制的遗传病,受b基因控制,分析下列遗传系谱,回答问题:

⑴Ⅲ-1产生的精子类型分别是 ;
⑵Ⅲ-2的基因型是 ,她是纯合体的概率为 ;
⑶如果Ⅳ-1是一个男孩,此男孩既是多指又是色盲的概率为 ,只患多指不患色盲的概率为 ;
⑷如果Ⅳ-2是一个女孩,则她只患色盲而不患多指的概率为 ,两病都不患的概率为 。
第III卷(选作题)
26. (26分)Ⅰ.(16分,每空2分)为了探究酵母
菌的呼吸方式, 某同学做了如下课题研究:
某同学做了如下课题研究:
(1).假设:在其他条件(如温度、PH值)
都相同的情况下,影响酵母菌的呼吸方式的
因素是氧气。(2).设计与实验:设计的实
验装置如图甲、乙所示。可重复实验以确保
结果的准确性。(3).得出结论:如果甲、乙
两装置中的石灰水都变浑浊,说明酵母菌既
能进行 ,也能进行 。
(4).实验分析:
①甲装置中的油脂层的作用是 ,甲、乙两装置中产生的气泡量较多的是 装置;产生能量较少的是 装置,原因是
。
②写出酵母菌进行有氧呼吸和无氧呼吸的反应式(以葡萄糖为底物)
有氧呼吸
无氧呼吸
Ⅱ.(10分)下图甲示缩手反射相关结构,图乙是图甲中某一结构的亚显微结构模式图。据图回答:
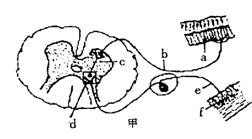

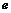




(1)甲图中a表示的结构是 ,乙图是甲图中 (填字母)的亚显微结构放大模式图,乙图中的B是下一个神经元的 (2分)。
(2)缩手反射时,兴奋从A传到B的信号物质是 。信号物质的释放体现了细胞膜具有 性,兴奋不能由B传到A的原因是 。
(3)突触后膜上的“受体”与相应神经递质结合,引起B细胞产生 (2分),使突触后膜的膜电位发生变化。
(4) 乙图所示结构A与B之间的液体为 。
22. (20分)如图所示,在平面直角坐标系xoy中的第一象限内存在磁感应强度大小为B、方向垂直于坐标平面向内的有界圆形匀强磁场区域(图中未画出);在第二象限内存在沿x轴负方向的匀强电场。一粒子源固定在x轴上的A点,A点坐标为
(20分)如图所示,在平面直角坐标系xoy中的第一象限内存在磁感应强度大小为B、方向垂直于坐标平面向内的有界圆形匀强磁场区域(图中未画出);在第二象限内存在沿x轴负方向的匀强电场。一粒子源固定在x轴上的A点,A点坐标为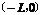 。粒子源沿Y轴正方向释放出速度大小为v的电子,电子恰好能通过y轴上的C点,C点坐标为
。粒子源沿Y轴正方向释放出速度大小为v的电子,电子恰好能通过y轴上的C点,C点坐标为 ,电子经过磁场后恰好垂直通过第一象限内与x轴正方向成15°角的射线ON(已知电子的质量为m,电荷量为e,不考虑粒子的重力和粒子之间的相互作用)。求:
,电子经过磁场后恰好垂直通过第一象限内与x轴正方向成15°角的射线ON(已知电子的质量为m,电荷量为e,不考虑粒子的重力和粒子之间的相互作用)。求:
(1)第二象限内电场强度的大小;
(2)圆形磁场的最小半径。
23, 某学校研究性学习小组设计实验探究铝等金属的性质:将一小片久置铝片投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是______。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是________________________________________。
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
负极 |
NaOH |
2Al-6e-+8OH-=2AlO2-+4H2O |
6H2O+6e-=6OH-+3H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Mg+2e-=Mg2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
其中正确的是____(填序号),由此推知,金属作电极不仅与本身性质相关,而且与____有关。
24, 已知高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液可以发生氧化还原反应。回答下列问题:
(1)该反应中的还原剂是 。
(2)写出该反应的化学方程式 。
(3)反应转移了0.4mol电子,则参加反应的H2SO4物质的量为 mol。
(4)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是:取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[ 化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 。
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是 KMnO4溶液应放在 [酸式滴定管,碱式滴定管]。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中的含钙 g。
25,[I] 科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资
源可持续利用的制氢气的方法是________。(选填字母)
A.电解水 B.锌和稀硫酸反应 C.光解海水 D.以石油、天然气为原料
(2)因氢气易燃易爆,贮运安全极为重要。已知氢气的燃烧热为285.8kJ·mol-1。写出其完全燃烧的热化学方程式: 。
(3)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验: ① 氢氧燃料电池中,正极的电极反应式为____________________________。
 ②右图装置中,某一铜电极的质量减轻 3.2g ,则 a 极上消耗的O2在标准状况下的体___L。
②右图装置中,某一铜电极的质量减轻 3.2g ,则 a 极上消耗的O2在标准状况下的体___L。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极附近的pH________。(填“增大”、“减小”或“不变”)
[II] 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)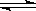 CH3OH(g)
△H<0
CH3OH(g)
△H<0
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
A.氢气的浓度减少 B.正反应速率加快,逆反应速率减慢
C.甲醇的物质的量增加 D.重新平衡时c(CO)/c(CH3OH)不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com