
题目列表(包括答案和解析)
2.有时候,由于实验材料用品所限而需要设法替代。下列各项中正确的是:
A.做植物细胞有丝分裂实验时,可用蒜叶代替洋葱的根
B.做植物细胞质壁分离和复原实验时,可用30%的KNO3溶液代替30%的蔗糖溶液
C.做叶绿体色素提取和分离实验时,可用丙酮代替乙醇提取色素
D.做DNA粗提取与鉴定实验时,可用新鲜猪血代替鸡血
1.“野火烧不尽,春风吹又生”是对草原生态系统的一种描述,此现象能说明:
A. 草原生态系统的抵抗力稳定性很高
B.草原生态系统的更新速度很快,生产力很高
C.草原生态系统的恢复力稳定性很高
D.草原生态系统的自动调节能力很强,不易受外界干扰的影响
31.I(8分)通过DNA重组技术培育成的动物称为转基因动物。运用这一技术可使羊奶中含有人体蛋白质,下图表示了这一技术的基本过程,在该工程中所用的基因“剪刀”能识别的序列平和切点是- -,请回答:
-,请回答:
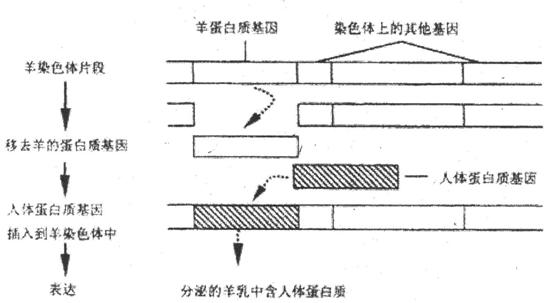
(1)从羊染色体中“剪下”羊蛋白质基因的酶是 。人体蛋白质基因“插入”后连接在羊体细胞染色体中时需要的酶是 。
(2)请画出运载体质粒被切割后形成黏性末端的过程图。
|
-  - - |
(3)与人肠杆菌细胞的基因相比,人体蛋白质基因编码区的主要特点是:
II(14分)人体细胞内含有抑制癌症发生的p53基因,生物技术可对此类基因的变化进行检测。

(1)人工合成目的基因的方法通常包括 和 。
(2)上图表示从正常人和患者体内获取的p53基因的部分区域。与正常人相比,患者在该区的碱基会发生改变,在上图中用方框圈出发生改变的碱基对(见上图);这种变异被称 为 。
(3)已知限制酶E识别序列为CCG,G,若用限制酶E分别完全切割正常人和患者的 p53基因部分区域(见上图),那么正常人的会被切成 个片段;而患者的则被切割成长度为 对碱基和 对碱基的两种片段。
(4)如果某人的p53基因部分区域经限制酶E完全切割后,共出现170、2.20、290和460碱基对的四种片段,那么该人的基因型是 (以A表示正常基因,a表示异常基因)。
30.(20分)小白鼠是常用的实验动物。图示是利用小
白鼠生产单克隆抗体过程。
(1)图中小鼠经免疫的B细胞最终来源于红骨髓中
的分裂与分化。
(2)单克隆抗体本质是 .制备单克隆抗
体过程中一共要进行三次次动物细胞培养,两
次筛选。筛选l是指利用选择培养基,筛选出
杂交瘤细胞。因图中抗原有四个抗原决定簇,
所以还要经筛选2选出 。
(3)该过程所产生的抗体与常规血清抗体比较,优
点是
(4)若图中的抗原是病毒,则其抗原特异性由
直接决定。
(5)生产单克隆抗体过程中,配制好培养基后,必须经过严格的 处理。若不小心在
培养基中混入了大肠杆菌,且产生大量毒素,理论上可以用. 鉴别出大肠杆菌,毒素属于大肠杆菌 产物。试问,此培养基中能否混入产甲烷杆菌? .理由: 。
29. (14分)如图所示,向2 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g
H20,在一定温度一定温度下,发生如下可逆反应:
(14分)如图所示,向2 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g
H20,在一定温度一定温度下,发生如下可逆反应:

试回答下列问题:
(1)2s时,测得容器中含有O.04 mol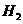 ,则用C0表示的反应速率为
。
,则用C0表示的反应速率为
。
(2)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (填序号)。
①体系的压强不再发生变化。
②容器内气体的密度不在发生变化。
③生成n mol C0的同时生成n mol 键
键
④lmol H-H键断裂的同时断裂2mol H-O 键。
(3)上述反应达到平衡后,若改变下列条件 ,平衡向正反应方向移动的是 (填序号)。
①升高温度 ②加入l2 g C ③加入9 g H20 ④充入一定量的He
(4)上述反应达剑平衡后,测得H2的浓度为C mol/L, 若按如下配比改变起始加入量,则达到平衡后,H2的浓度仍为C mol/L 的是 (填序号)。
① 54 g
C(s)、18 g 
② 2 mol C0、2 mol
③ 18 g 、1 mol C0、l mol
、1 mol C0、l mol
④ 24 g C(s)、9 g 、0.5 mol C0、0.5 mo1
、0.5 mol C0、0.5 mo1
(5)上述反应达到平衡后,若缩小容积(其它条件不变),则容器内气体的平均相对分子质量
将 (填“不变”、“变小”、“变大”),若起始时同时投放C(s)、 (g)、CO(g)、
(g)、CO(g)、 (g),达到平衡后,容积内气体混合物的平均相对分子质量
(g),达到平衡后,容积内气体混合物的平均相对分子质量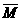 取的取值范围是
。
取的取值范围是
。

28.(16分)A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:
①A元素中的一种原子没有中子。
②B元素原子最外层电子数是次外层电子数的2倍。
③C元素最高正价与最低负价的代数和为2。
④A与D能以原子个数比1:1、2:1形成两种液态化合物。
⑤ 离子的电子层结构与氖原子相同。
离子的电子层结构与氖原子相同。
⑥F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素的化合物。
⑦C、F两种元素质子数之和是B元素质子数的4倍。
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为 ,F简单阴离子的结构示意图 , 化合物AFD的电子式为 ,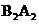 的结构式为 。
的结构式为 。
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到B个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的分子式 ;分子中B、C原子间的化学键的类型为 (填“极性键”或“非极性键”),属于 分子(填“极性” 或“非极性” ),x与水反应的化学方程式为 。
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y。在化合 物Y中,A、B两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为 ,Y的硬度比金刚石硬度大的原因是 .
27.(15分) 的还原性较强,可以被
的还原性较强,可以被 、
、 、
、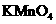 、
、 等很多氧化剂氧化,请配平下列氧化还原反应方程式:
等很多氧化剂氧化,请配平下列氧化还原反应方程式:
 +
+  +
+
 =
=
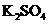 +
+  +
+  +
+ 
已知将溶液中的 、
、 、
、 完全转化为氢氧化物沉淀,需溶液的pH分别为6.7、9.0、3.2。现有含
完全转化为氢氧化物沉淀,需溶液的pH分别为6.7、9.0、3.2。现有含 杂质的氯化铜晶体(
杂质的氯化铜晶体( ·
· ),为制取纯净的
),为制取纯净的 ·
· ,首先将其制成水溶液,然后按下图所示步骤进行提纯:
,首先将其制成水溶液,然后按下图所示步骤进行提纯:
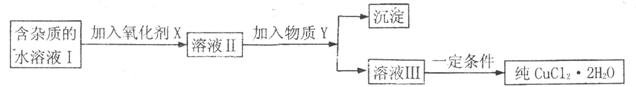
请回答下列问题:
(1)本实验最适合的氧化剂X是 。
A. B.
B. C.
C. D.
D.
(2)物质Y不可以是 。

(3)加入氧化剂的目的是 。
(4)除去 件的有关离子方程式是(物质Y在(2)中选择合适的选项)
件的有关离子方程式是(物质Y在(2)中选择合适的选项)
; 。
(5)最后能不能直接蒸发结晶得到 (填“能”或“不能”)。如不能,
(填“能”或“不能”)。如不能,
应如何操作?(如能,此空不填) 。
26.(15分)实验室通过实验测定NaOH溶液和盐酸反应的中和热。实验需用约450 mL 0.50 mol/LNaOH溶液。
提供的实验仪器:托盘天平,玻璃棒,胶头滴管,烧杯若干,容量瓶(100mL,250mL,500mL各一个)等;
提供的实验用品:NaOH固体,0.50 mol/L盐酸,纸片等。
(1) 配制0.50 mol/L NaOH溶液:将NaOH固体放在 (填实验用品或仪器的名称),用托盘天平称量 g NaOH固体。在使用容量瓶前必须进行的操作是 。
(2) 下列操作会使所配溶液的浓度偏高的是(填序号) 。
 A.烧杯、玻璃棒没有洗涤
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线。
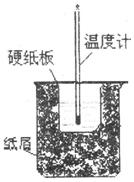
(3) 将50 mL 0.50 mol/L盐酸与60 mL0.50 mol/L NaOH溶液在右图所示
的装置中进行中和反应。从实验装置上看,图中尚缺少的一种玻璃仪
器是 。
(4) 一定量的稀盐酸和过量的NaOH溶液反应,当生成1 mol 时放出的
时放出的
热量为57.3 kJ,则该反应的热化学方程式为 。
已知:①
②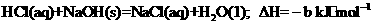
③
则a、b、c三者的大小关系为 (填字母)
A.a b
b c B.b
c B.b c
c a C.a=b=c D.无法比较
a C.a=b=c D.无法比较
25.有 个完全相同的小物块静止放在光滑水平面上沿一直线排开,相邻小物块间距离均为
个完全相同的小物块静止放在光滑水平面上沿一直线排开,相邻小物块间距离均为 .现使物块l以初速度
.现使物块l以初速度 向物块2运动,碰撞后粘在一起,又向物块3运动,粘在一起后又向物块4运动……如此进行下去.
向物块2运动,碰撞后粘在一起,又向物块3运动,粘在一起后又向物块4运动……如此进行下去.
求: (1)前面物块与第 个木块粘在一起时的速度大小
个木块粘在一起时的速度大小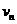 ;
;
(2)从物块l开始运动时,到物块 开始运动经历的总时间.(忽略每次碰撞所用的时间)
开始运动经历的总时间.(忽略每次碰撞所用的时间)
24.现根据对某一双星系统的光学测量确定,该双星系统中每个星体的质量都是M,两者相距L,它们正围绕两者连线的中点做圆周运动。万有引力常量为G。求:
(1) 试计算该双星系统的运动周期T
(2) 若实验上观测到运动周期为 ,且
,且 ,为了解释两者的不同,目前有一种流行的理论认为,在宇宙中可能存在一种望远镜观测不到的物质--暗物质,作为一种简化的模型,我们假定在以这两个星体连线为直径的球体内均匀分布着这种暗物质,而不考虑其他暗物质的影响,试根据这一模型和上述观测结果确定该星系间这种暗物质的密度。
,为了解释两者的不同,目前有一种流行的理论认为,在宇宙中可能存在一种望远镜观测不到的物质--暗物质,作为一种简化的模型,我们假定在以这两个星体连线为直径的球体内均匀分布着这种暗物质,而不考虑其他暗物质的影响,试根据这一模型和上述观测结果确定该星系间这种暗物质的密度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com