
题目列表(包括答案和解析)
4、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑
3、碳酸不稳定而分解:H2CO3 === H2O + CO2↑
2、过氧化氢分解氧气:2H2O2 MnO2 2H2O+O2↑
1、加热高锰酸钾:2KMnO4 △K2MnO4 + MnO2 + O2↑
(1)金属单质 + 酸 →盐 + 氢气
(2)金属单质 + 盐(溶液)→另一种金属 + 另一种盐
(3)金属氧化物+木炭或氢气→金属+二氧化碳或水
0.96g
答:需要15%的过氧化氢溶液13.6g。
方案三:选择5%的过氧化氢溶液作为制取氧气的试剂(解法与方案二相似,答案为40.8g,解题过程略)
综上所述,综合计算题情境较复杂,同学们一定要注意把定性思考和定量计算结合起来,要善于透过现象来抓反应的本质,对于信息题及联系实际的计算题,解题关键在于审题,从题目所给信息分析利用哪部分知识可以解决问题。图像型和表格型的计算题中已知数据大部分以图像或表格数据的形式出现,具有一定的隐蔽性,解答这类题的关键是通过分析图像涵义以及对表格中的数据做横向、纵向比较等方法,挖掘出隐含在图像或表格中的已知条件,再进行解答。另外,要注意解题过程的完整性。
本资料由《七彩教育网》 提供!
5. 实验型计算题
例5. 某课外活动小组在研究“氧气对生物体生命活动的影响”时,需要制取一定量的氧气。
(1)下列是该小组的同学设计的几种制取氧气的装置及选用的试剂,其中错误的是( )
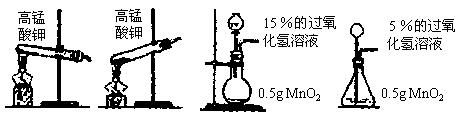
A B C D
(2)他们在实验中需要制取氧气的质量为0.96g,若让你选择,你会选择上图中的哪种实验方法?所需试剂的质量是多少?
解析:(1)用加热高锰酸钾制取氧气时,试管口应略向下倾斜,因此选项B是错误的。
(2)本题是一道开放性试题,方案有以下几种情况。
方案一:选择高锰酸钾作为制取氧气的试剂
解:设需高锰酸钾的质量为x。
316 32
x 0.96g
方案二:选择15%的过氧化氢溶液作为制取氧气的试剂
解:设需要15%的过氧化氢溶液的质量为x。
68 32
4. 信息型计算题
例4. 为测定混有少量氯化钠的碳酸氢钠(NaHCO3)固体的质量分数,现进行如下实验:向盛有13.6g该混合物的烧杯中加入109.5g稀盐酸,恰好完全反应。反应的化学方程式为:。反应过程中用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
求:(1)混合物中NaHCO3的质量分数是__________,计算步骤为_________。
(2)反应后所得溶液中溶质的质量分数为___________,计算步骤为__________。
解析:本题是一道信息型计算考题,其信息为碳酸氢钠(NaHCO3)与盐酸反应的化学方程式:,由此可知,反应后所得溶液中的溶质为NaCl,分析表中数据可知:完全反应后产生CO2的质量为: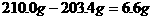
(1)设混合物中NaHCO3的质量为x,该NaHCO3与盐酸反应时生成NaCl的质量为y。
84 58.5 44
x y 6.6g
混合物中NaHCO3的质量分数为:
混合物中NaCl的质量为:
反应后所得溶液中NaCl的质量为:;
反应后溶液的质量为:。
所得溶液中溶质的质量分数为:。
3. 图像型计算题
例3. 研究性学习课题:探究实验室中久置NaOH的变质程度。
研究方案:先称取13.3g NaOH样品(杂质为Na2CO3),配制成溶液,然后向溶液中逐滴加入溶质质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度。
解决问题:实验测得加入稀盐酸的质量与产生CO2气体的质量关系如下图所示:
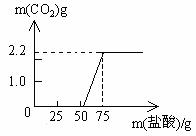
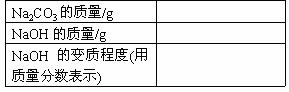
填写下表:(计算结果保留一位小数)
继续探究:计算实验过程中与NaOH反应消耗盐酸的质量。
发现问题:根据求得的与NaOH反应消耗盐酸的质量,对照图像,你发现了什么问题?
解析:此题为一道研究型考题,解题的关键是正确分析图像中有关数据的涵义。
解:13.3g NaOH样品与足量盐酸反应,最多可生成2.2g CO2,设其中所含Na2CO3的质量为x。
106 44
x 2.2g
则样品中NaOH的质量为:
设生成5.3g Na2CO3需NaOH的质量为y。
80 106
y 5.3g
y=4g 未发生变质时NaOH的总质量为:8g+4g=12g
所以NaOH的变质程度为:
继续探究:设与8g NaOH反应消耗盐酸的质量为z。
40 36.5
8g
比较图像中的横轴数据便会发现问题:NaOH被盐酸中和后,继续滴加盐酸,为什么没有立即产生CO2气体等。
2. 表格数据分析型计算题
例2. 某同学去我市的道场山风景区游玩时,取回了若干块矿石样品,它采用了以下的方法对样品中碳酸钙的质量分数进行检测:取这种石灰石样品6g,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中的杂质不溶于水,不与盐酸反应)。求:
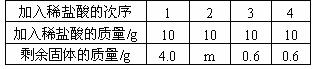
(1)6g石灰石样品中含有的杂质为_____________;
(2)m=____________;(3)样品中CaCO3的质量分数;(4)所用稀盐酸的质量分数。
解析:解答本题的关键是分析表中所给数据之间的关系,并做出正确的判断。(1)通过表中次序3和次序4的数据比较,可判断此时的石灰石中CaCO3已完全反应,且其中所含杂质的质量为0.6g,所含CaCO3的质量为:6g-0.6g=5.4g;(2)第一次加入10g盐酸,反应后剩余固体的质量为4.0g,说明10g盐酸消耗了2g CaCO3,因此第二次加入10g盐酸后所消耗CaCO3的质量共为4g,;(3)样品中CaCO3的质量分数为:5.4g/6g×100%=90%。
(4)设所用稀盐酸的质量分数为x。
100 73
2g 10g·x
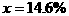
(提示:计算稀盐酸的溶质质量分数时,只能用前两次所用盐酸中的任一次,不能根据第三次或第四次盐酸的质量计算,因为这两次盐酸有剩余。)
答:(1)6g石灰石样品中含有的杂质为0.6g;(2)m=2g;(3)样品中CaCO3的质量分数为90%;(4)所用稀盐酸的质量分数为14.6%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com