
题目列表(包括答案和解析)
4. 用某种培养基培养谷氨酸棒状杆菌,测得其生长曲线如图A所示。谷氨酸是谷氨酸棒状杆菌的代谢产物之一,其合成途径如图B所示。下列有关叙述,错误的是
用某种培养基培养谷氨酸棒状杆菌,测得其生长曲线如图A所示。谷氨酸是谷氨酸棒状杆菌的代谢产物之一,其合成途径如图B所示。下列有关叙述,错误的是
A.该培养基是恒定容积的液体培养基,含有五大类营养物质
B.由于谷氨酸棒状杆菌是单细胞生物,每个细胞都具有全能性,故无基因的选择性表达现象
C.在图A中的3时期,谷氨酸棒状杆菌的种内斗争最剧烈
D.在图B中,谷氨酸脱氢酶活性被抑制的主要原因是其结构发生可逆性改变,此种调节方式具有快速、精细的特点
3.已知某植物发育着的种子的胚和胚乳的基因型分别是Bb、BBb,则下列有关说法正确的是
A.它们的B基因来自母方,b基因来自父方;
B.B基因只有一条链的全部区段参与转录,翻译的蛋白质中氨基酸是基因碱基总数的1/6;
C.如果B基因突变为等位基因B′,但个体性状没改变,这个突变可能发生在终止密码子上;
D.种子的胚是由顶细胞发育来的,胚乳则是由基细胞发育来的。
2. 如图所示,将连接灵敏电压表的导线两端置于神经纤维的外表面或内部(已知表的指针向电流流入表内的接线柱一侧偏转),显示神经纤维兴奋部位膜电位的是
如图所示,将连接灵敏电压表的导线两端置于神经纤维的外表面或内部(已知表的指针向电流流入表内的接线柱一侧偏转),显示神经纤维兴奋部位膜电位的是
1.下列对人体生命活动调节的叙述不正确的是
①世界杯足球赛时,球员踢球瞬间,神经冲动在神经纤维上的传导形式是突触传导。
②对于高烧不退的病人,在对症下药治疗的同时,还可加盖棉被,增加排汗量来辅助降低体温。
③对于较重的糖尿病患者,除了控制饮食外,还需按照医生的要求注射胰岛素进行治疗
④如果破坏实验鼠的大脑,保留下丘脑及其以下神经结构,该鼠体温仍相对稳定。
⑤当人处于寒冷的环境中时,皮肤的血管舒张,立毛肌收缩。
⑥过敏反应是指已免疫的机体,在再次接受相同过敏原刺激时所发生的反应,此时体液中相应的抗体浓度迅速增加。
A.①②⑤⑥ B.①②⑤ C.①②④⑥ D.②④⑤⑥
31. Ⅰ.(22分)某自花传粉植物灰种皮(Y)对白种皮(y)为显性,紫茎(A)对绿茎(a)为显性,抗病(B)对感病(b)为显性,各由一对等位基因控制,并分别位于三对同源染色体上,且当花粉含AB基因时不能萌发长出花粉管。请回答:
⑴如果只考虑种皮颜色的遗传:将基因型为 的植株自交所结全部种子播种共得15株植株,其中有10株结灰色种子共300粒,有5株结白色种子共100粒,则子代的性状分离比与孟德尔定律预期分离比可能
(填相符或不相符),最可能的原因是
。
的植株自交所结全部种子播种共得15株植株,其中有10株结灰色种子共300粒,有5株结白色种子共100粒,则子代的性状分离比与孟德尔定律预期分离比可能
(填相符或不相符),最可能的原因是
。
⑵如果只考虑茎的颜色和抗病性状的遗传:让基因型为 的植株和
的植株和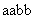 的植株相互受粉,正交和反交产生的子代性状分离比
(填相同或不相同),原因是
的植株相互受粉,正交和反交产生的子代性状分离比
(填相同或不相同),原因是
。
⑶用基因型为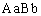 的植株作材料,可以采用
育种方法获得基因型为
的植株作材料,可以采用
育种方法获得基因型为 的紫茎抗病植株。
的紫茎抗病植株。
⑷若杂交育种的两个杂交亲本各具有期望的优点,则杂交后,F1自交能产生多种非亲本类型,其原因是F1在______________形成配子过程中,位于______________基因通过自由组合,或者位于______________基因通过非姐妹染色单体交换进行重新组合。假设杂交涉及到n对相对性状,每对相对性状各受一对等位基因控制,彼此间各自独立遗传。在完全显性的情况下,从理论上讲,F2表现型共有____________种,其中纯合基因型共有_____种,杂合基因型共有______________种。
Ⅱ.(12分) 2N/4N 嵌合体胚胎是指用四倍体 (4N )胚胎与二倍体胚胎(2N )或胚胎干细胞 (ES 细胞)进行聚合,形成由二倍体和四倍体细胞组成的嵌合体。2N/4N 嵌合体胚胎的 构建常用方法如下图,请据图分析回答:
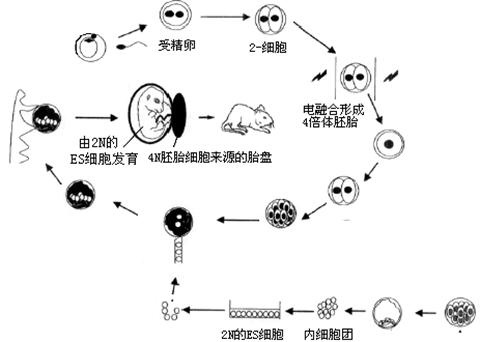
⑴受精卵是胚胎发育的开端,图中的卵细胞成熟后,才具备与精子受精的能力,而精子需经过 过程才能和卵细胞结合。
⑵2N的ES细胞来自胚胎发育过程的 期,本实验中从功能上说明了该细胞
⑶2N/4N嵌合体胚胎的构建用到的现代生物工程技术有: 、 、
⑷ES细胞经嵌合体方法培育的动物与核移植方法培育的动物相比,遗传物质来源的区别主要是 。
 温州中学2009学年第一学期期末考试
温州中学2009学年第一学期期末考试
30.(10分)人类多种先天性贫血是由于红细胞本身的遗传缺陷引起的。请回答:
⑴某人常出现紫绀,经医生检查其血红蛋白的B链上第67位氨基酸为谷氨酸(密码子为GAA或GAG),而正常人是缬氨酸(密码子为GUU、GUC、GUA、GUG),该病在医学上称为先天性高铁血红蛋白症Ⅱ型。引起该病的根本原因是患者有关基因的转录链上的一个脱氧核苷酸发生了改变,具体变化是 。
⑵.人类有一种非球形红细胞性贫血(Ⅱ型),经查为糖代谢过程某个环节发生障碍。一位男孩患上述疾病(一种单基因遗传病),进一步调查,发现该男孩的外祖母、两个舅舅和祖父都患此病,而他的祖母、外祖父、两个姑姑,父亲、母亲都正常。请根据这个男孩及其相关的家庭成员的情况,判断该致病基因最可能位于 染色体上,属于 性遗传病,理由 。并绘制该家族遗传系谱图。

29.(19分)已知0.1mol有机物A的质量是12g,在足量的氧气中充分燃烧后生成35.2g CO2和7.2g H2O; A可以发生银镜反应,其苯环上的一卤代物有三种。
⑴A的分子式是_____________,A中含氧官能团的名称是____________,A的结构简式为______________________。

现有如下转化关系:

其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
⑵C可能具有的化学性质有______________(填序号)
①能与H2发生加成反应 ②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应 ④能与Ag(NH3) 2OH溶液发生银镜反应
⑶写出下列反应的化学方程式(有机物用结构简式表示)
①C转化为D的反应________________________________________________;
②一定条件下,D生成高聚物的反应___________________________________;
③G与足量NaHCO3溶液的反应_______________________________________。
⑷向盛有5 mL G饱和溶液的试管中滴入3滴用稀硫酸酸化的KMnO4溶液,振荡,溶液的紫红色褪去。已知MnO4-转化为Mn2+,则该反应的化学方程式为:
___________________________________________________________________
⑸C的同分异构体有多种,其中符合下列要求的有机物有____________种
①与C具有相同的官能团种类 ②遇三氯化铁溶液不显色
③苯环上的一氯代物只有两种
写出其中一种有机物的结构简式 。
28.(11分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行测定,填写下列空白。
[方案一]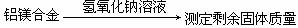
⑴称取5.4g铝镁合金粉末,投入一定体积 2.0mol·L-1的NaOH溶液中,为了使合金中铝能完全溶解,NaOH溶液至少应取___________mL
⑵过滤、洗涤、干燥、称量固体。若该步骤中所得固体未经洗涤,则测得镁的质量分数将________________(填“偏高”、“偏低”或“不变”)
 [方案二]
[方案二]
实验装置如右图。
⑶某同学提出该实验装置不够完善,应在A、B之
间添加一个干燥、除酸雾的装置。你的意见是
_________(填“需要”或“不需要”)
⑷为使测定结果尽可能精确,实验中应注意的问题是(写出其中两点)
①______________________________;②________________________________
 [方案三]称量x g铝镁合金粉末,放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
[方案三]称量x g铝镁合金粉末,放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
⑸欲计算Mg的质量分数,该实验中还需测定
的数据是_______________________________
⑹若用空气代替O2进行实验,对测定结果是否
有影响?___________(填“是”或“否”)。
27.(14分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
⑴298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图如下所示,据图回答问题:

①写出合成氨反应的热化学方程式_____________________________________;
②在图中曲线_____(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理____________________________________________________;
③目前合成氨工业广泛采用的反应条件是500℃、20-50MPa、铁触媒作催化剂,反应转化率不超过50%。工业上为了进一步提高氨气的产率,你认为下列措施经济可行的是____________________;
A.升高反应温度,让更多的分子变成活化分子
B.降低反应温度,让反应向着有利于氨气生成的方向进行
C.将液氨及时从反应体系中分离出来
D.寻求能在更低的温度下有很强催化活性的新型催化剂
⑵在10L的恒容密闭容器中充入一定量的N2和H2,在某温度下发生如下反应:
N2(g)+3H2(g) 2NH3(g),N2、H2、NH3的物质的量变化如图所示。
2NH3(g),N2、H2、NH3的物质的量变化如图所示。
 ①3min内,用H2的浓度变化表示的反应速率为
①3min内,用H2的浓度变化表示的反应速率为
____________________________
②此条件下该反应的化学平衡常数K=___________
若升高温度,则平衡常数K将__________________
(填“增大”或“减小”或“不变”)
③反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2、1 mol H2和0.4mol NH3 ,化学平衡将_______________ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
26. (16分)X、Y、Z、W均为含有10电子的微粒,W为阳离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4。
(16分)X、Y、Z、W均为含有10电子的微粒,W为阳离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4。
⑴X的电子式 ;若实验室用右图
所示装置制取X,则制取X的化学反应方程式为
_________________________________________。
⑵已知: W + X + H2O → 白色沉淀。
①由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
②为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
 ⑶常温下,取10 ml pH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则Y的化学式为__________。
⑶常温下,取10 ml pH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则Y的化学式为__________。
下列有关Y的叙述正确的是__________
①Y溶于水后部分发生电离
②Y的水溶液中滴加石蕊试液会变红
③稀释后溶液中所有离子的浓度均减小
④稀释后,阴离子的物质的量浓度之和不变
⑷已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2 的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com