
题目列表(包括答案和解析)
11、混合物的分离:把混合物里的各种物质分开,得到混合物中每一组分的纯净物。
常用的物理方法有:溶解、过滤、结晶等
化学方法是:通过化学反应,使某些组分变为与原物质不同状态的物质而分开
*过滤:分离一种溶另一种不溶的混合物。
*结晶:从溶液里得到有一定几何形状的晶体的过程叫结晶。
结晶方法:①蒸发溶剂结晶(适用于溶解度受温度影响小的固体,如NaCl)
从盐水中得NaCl固体可采用蒸发溶剂的方法。
②冷却热的饱和溶液结晶(适用于溶解度受温度影响大的固体,如硝酸钾)此方法还可分离硝酸钾和氯化钠的混合物,得较纯的硝酸钾晶体。
10、溶液:
①溶液:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
*溶液由溶质和溶剂组成。(在溶液里的反应,一般是溶质参加反应)
*溶液中溶剂只有一种,而溶质可以是一种也可以是多种。
②溶质:被溶解的物质叫溶质(可以是气体、液体或固体),但没有溶解的物质不是溶液的一部分,不能认为是溶质。例:20℃时,50克食盐放入100水中,没有溶解的24克食盐不是溶质,不是溶液的一部分
**K2O、CaO、Na2O、BaO、CO2、SO2、SO3、P2O5溶于水后溶质是它们与水反应的生成物。
**结晶水合物溶于水后溶质是没有结晶水的物质。如:CuSO4•5H2O溶于水后溶质是CuSO4。
③溶剂:能溶解其他物质的物质叫溶剂。
*由固体或气体与液体组成的溶液中溶剂通常是液体,不指明溶剂的溶液其溶剂是水。
*由液体与液体组成的溶液中,量多的为溶剂,量少的为溶质。如果有水存在,水一定是溶剂。
④溶液的分类:(饱和溶液和不饱和溶液)
*饱和溶液:在一定的温度下,一定量的溶剂里,不能再溶解某种溶质溶液叫做这种溶质的饱和溶液。(蒸发溶剂有晶体析出,剩余溶液一定是饱和溶液)
*不饱和溶液:在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液。注意:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
*同种溶质在同一温度下,饱和溶液比不饱和溶液的浓度大
*饱和溶液与不饱和溶液的相互转化
一般情况下:向饱和溶液加溶剂或升高溶液温度可使饱和溶液变为不饱和溶液;向不饱和溶液加溶质、降低溶液温度、蒸发溶剂可使不饱和溶液变为饱和溶。
加溶质②降低溶液温度③蒸发溶剂

 不饱和溶液
饱和溶液
不饱和溶液
饱和溶液
加溶剂②升高溶液温度
加溶质②降低升高溶液温度③蒸发溶剂

 Ca(OH)2不饱和溶液
Ca(OH)2饱和溶液
Ca(OH)2不饱和溶液
Ca(OH)2饱和溶液
加溶剂②溶液温度
⑤固体的溶解度:在一定温度下,某固态物质在100克溶剂达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
(关键词:一定的温度 100克溶剂 达到饱和状态 溶质质量)
⑥溶解度曲线:物质的溶解度随温度变化的曲线。
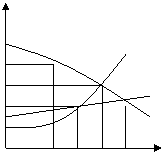 **大部分固体的溶解度随温度升高而增大(如A物质),但NaCl的溶解度受温度影响很小(如B物质),熟石灰的溶解度随温度高而减小(如C物质)。
**大部分固体的溶解度随温度升高而增大(如A物质),但NaCl的溶解度受温度影响很小(如B物质),熟石灰的溶解度随温度高而减小(如C物质)。
S 点:a点表示在t1℃时C物质的溶解度是m克。
b点表示t2℃时A物质各B物质的溶解度都是p克。
m 线:*A、B、C三种饱和溶液由t4℃降温到t1℃时,AB
n a A 有晶体析出,溶液仍为饱和溶液;C没有晶体析出,
p c B 溶液变成不饱和。
b d C *温度在低于t3℃时,C物质的溶解度大于A物质的
T 溶解度;温度在高于t3℃时,A物质的溶解度大于C物质
t1 t2 t3 t4 溶解度。
**气体的溶解度随温度降低、压强的增大而增大。
⑦固体溶解度与溶解性的关系:
|
溶解性 |
易溶 |
可溶 |
微溶 |
难溶(或不溶) |
|
20℃的溶解度(克) |
>10 |
1-10 |
0.01-1 |
<0.01 |
常见难溶于水的物质有:大部分金属、金属氧化物、BaSO4、AgCl、CaCO3等碳酸盐
⑧溶液的酸碱性(度):酸碱性用酸碱指示剂(石蕊试液、无色酚酞)测量,酸碱性度(PH值)用PH试纸测量。
|
|
酸性 |
中性 |
碱性 |
|
PH值 |
《7 |
=7 |
》7 |
|
紫色石蕊试液 |
红色 |
紫色 |
蓝色 |
|
无色酚酞试液 |
无色 |
无色 |
红色 |
|
PH试纸 |
红色 |
黄色 |
蓝色 |
⑨溶液的导电性:所有的酸、碱、盐水溶液都具有导电性。(原因是它们的溶液中有自由移动的电荷)***所有的溶液不带电。
⑩溶液中的离子共存:阳离子与阴离子结合,产生气体或水或沉淀时,离子不能共存。
9、常见试剂:
①催化剂(触媒):一变(在化学反应里能改变其他物质的化学反应速率)二不变(而本身的质量和化学性质在化学反应前后都没有改变的物质)。催化作用:催化剂在化学反应里所起的作用叫催化作用。
注意:二氧化锰只是在氯酸钾分解的反应里作催化剂,在其他反应里可能不是催化剂。
②还原剂:在化学反应中得到氧的物质。常用的还原剂有H2 、CO、C等具有还原性。
③氧化剂:在化学反应中失去氧的物质。常用的氧化剂有O2等具有还原性。
④干燥剂:易吸收或与水反应的物质。常用的干燥剂有氢氧化钠、氧化钙(但不能干燥酸性气体如CO2、SO2等)、浓硫酸(但不能干燥碱性气体如NH3等)
8、化学用语:
①元素符号(熟记下列元素名称、符号)
|
核电荷数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
元素名称 |
氢 |
氦 |
锂 |
铍 |
硼 |
碳 |
氮 |
氧 |
氟 |
氖 |
|
元素符号 |
H |
He |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
核电荷数 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
元素名称 |
钠 |
镁 |
铝 |
硅 |
磷 |
硫 |
氯 |
氩 |
钾 |
钙 |
|
元素符号 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
K |
Ca |
|
元素名称 |
锰 |
铁 |
铜 |
锌 |
钡 |
银 |
碘 |
金 |
汞 |
铂 |
|
元素符号 |
Mn |
Fe |
Cu |
Zn |
Ba |
Ag |
I |
Au |
Hg |
Pt |
书写原则:一大二小
符号涵义:一种元素、该元素的一个原子、(少数表示)一种单质(金属、稀有气体、常温下固态非金属单质都可以直接用元素符号表示)
*元素符号前的系数表示原子个数。
②离子符号
书写:元素符号电荷数+或-(电荷数=1时,1省略)
例:2Mg2+ 前面的“2”表示二个镁离子,后面的“2”表示每个镁离子带2个单位的正电荷。
*离子符号前的系数表示离子个数。
*Fe2+亚铁离子、 Fe3+铁离子 *常见的原子团:SO42-、CO32-、NO3-、OH-、ClO3-、PO43-、NH4+
③化合价 +或-化合价数值 +2
书写: 元 素 符 号 例:Mg 表示:镁元素的化合价为+2价。
离子和化合价书写的区分:肩担离子头顶价,数前离子数后价。
④化学式
书写(用化合价书写化学式):正价左负价右,十字约简定个数,写右下验对错。
单质的书写:①气态非金属单质:在元素符号的右下角加2
②金属、固态非金属、稀有气体单质:直接用元素符号。
氧化物的书写:氧元素写在右边。 酸的书写:H+酸根 碱的书写:金属元素+OH(氨水除外)
盐的书写:金属元素或氨根+酸根
化学式的涵义:表示一种物质、元素组成、一个分子、构成一个分子中的原子个数。
*化学式中元素符号右下角的系数表示构成一个分子中的原子个数。
*化学式前系数表示分子个数。
⑤化学方程式
书写原则:客观事实和质量守恒定律。
书写:写好化学式,分清反应、生成物,条件要居中、状态要写清,系数要配平,不要忘等号。
涵义:①表示反应中的反应物、生成物、反应条件及状态。
②表示反应中的反应物和生成物的质量比=物质的相对分子质量×计量数之比
③表示反应中的粒子数之比=计量数之比
必记的化学方程式:
2NaOH+CO2===Na2CO3+H2O CO2 +Ca(OH)2 ==CaCO3↓+ H20
Zn+H2SO4==ZnSO4+H2↑ 2H2O2MnO2====2H2O+O2↑
2KMnO4△====K2MnO4+MnO2+O2↑ 2KClO3MnO2====2KCl+3O2↑
Fe+2HCl==FeCl2+H2 Fe+CuSO4==FeSO4+Cu
Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
CuO+H2SO4==CuSO4+H2O CaCO3+2HCl==CaCl2+H2O+CO2
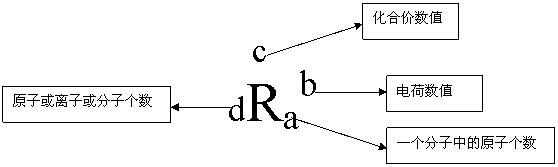
符号总结:
7、结构示意图(原子结构示意图、离子结构示意图)
①区分:质子数-核外电子数=0为原子结构示意图
质子数-核外电子数》0为阳离子结构示意图
质子数-核外电子数《0为阴离子结构示意图
②原子结构示意图:(主要看最外层)
元素的化学性质跟原子的最外层电子数关系最密切,原子的最外层电子数决定元素的化学性质:
*最外层电子数小于4时,易失去最外层所有电子,成为阳离子(通常是金属元素)
*最外层电子数多于4时,易得到电子使最外层电子数变为8,成为阴离子(通常是非金属元素)
*最外层电子数等于8(只有一层电子层为2)时,不得失电子为稳定结构(通常是稀有气体元素)
*最外层电子数与化合价的关系:失多少为正多少价,得多少为负多少价。
*电子层数=周期数,最外层电子数=族数
③不管是什么结构示意图,只要:1、质子数相同属于同一种元素;2、最外层电子数相同,化学性质也相同;3、最外层电子为8时稳定结构。
6、元素:具有相同核电荷数(即核内质子数)的一类原子总称元素。
*原子的核电荷数(即核内质子数)决定原子或离子的元素种类。
①大部分单个的元素符号表示:一种元素、该元素的一个原子、(少数表示)一种单质(金属、稀有气体、常温下固态非金属单质都可以直接用元素符号表示)
②地壳中元素按质量分数由多至少前四位是:O氧 Si硅 Al铝 Fe铁。铝是地壳中含量最多的金属元素。
③化学的“语法”:*“某分子”由“某原子构成”
*“某物质”由“某元素组成”
*“某物质”由“某某分子或原子或离子构成”(金属单质、稀有气体、常温下固态非金属单质由某原子直接构成)例:水由氢元素和氧元素组成,水由水分子构成。1个水分子由2个氢原子和1个氧原子构成
*元素、物质都是宏观概念,只表示种类,不表示个数。不能说“水是由二个氢元素和一个氧元素组成”
④具有相同核电荷数的粒子不一定是同种元素,
(因为粒子包括原子、分子、离子,而元素不包括多原子所构成的分子或原子团)只有具有相同核电荷数的单核粒子(一个原子一个核)一定属于同种元素。
5.构成物质的粒子:分子、离子、原子(既表示种类又可表示个数)
①分子是保持物质化学性质的最小粒子。分子由原子构成,例:1个水分子由2个氢原子和1个氧原子构成 ,分子用化学式来表示。
分子的基本性质:小、轻、分子在不断运动、分子之间有间隔、同一种物质的分子化学性质相同
分子基本性质的运用:“分子在不断运动”解释:溶解、升华、挥发、液化、气味等。注意:温度越高分子运动加速。“分子之间有间隔”解释:体积变化、三态变化、溶解、热胀冷缩等。
②原子是化学变化中的最小粒子。(注意:原子不是构成物质的最小粒子。)原子用元素符号表示。
*原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。
 对于中性粒子(原子、分子):核电荷数=质子数=核外电子数
对于中性粒子(原子、分子):核电荷数=质子数=核外电子数
对于任何粒子(原子、分子、离子):核电荷数=质子数
原子的质量主要集中在原子核上,相对原子质量=质子数+中子数
原子失电子带正电,得电子带负电(粒子失电子后不一定带正电,得电子后不一定带负电)
注意:原子不是构成物质的最小粒子。原子只是化学变化中的最小粒子;
普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
*分子和原子的区别:在化学变化中分子可分为更小的粒子---原子,原子不能再分。
物质发生物理变化时只是分子间的间隔发生变化,而分子本身没有发生变化;发生化学变化时,分子被破坏,分子本身发生变化。
*在一切化学反应中,反应前后元素的种类、原子的种类、原子的数目和原子的质量都不变。
**原子团:由两种或两种以上元素的原子构成,在化学反应中通常以整体参加反应的原子集团
常见的原子团:SO42-、CO32-、NO3-、OH-、ClO3-、PO43-、NH4+
*注意:原子团只是化合物中的一部分,不能脱离物质单独存在,因此含原子团的物质必定有三种或三种以上元素,二种元素组成的物质不含原子团。原子团在化学反应中可再分为更小的粒子原子。
③离子:带电的原子或原子团叫离子。带正电的离子叫阳离子;带负电的离子叫阴离子。
*离子里:质子数=核电荷数=电子数±带电量
*离子符号的写法:离子的电荷数标在右上角,电荷的数值等于它对应的化合价
*阳离子:Na+ Mg2+ Al3+ 、H+ NH4+、Fe2+亚铁离子 Fe3+铁离子 Ca2+
*阴离子:O2- 、OH- S2-、Cl- SO4 2- CO32- NO3-、PO43-、ClO3-
总结:(1)分子既能构成非金属单质(如:H2、O2、N2、等),又能构成非金属化合物(如HCl、CO2、H2O、NH3、等)。(2)原子只能构成单质(如所有金属、稀有气体、碳、金刚石、石墨、硅等)(3)离子只能构成离子化合物(常见盐、碱、碱性氧化物都属离子化合物)判断离子化合物的方法:凡含金属元素或NH4+的化合物都是离子化合物
(4)不带电的粒子:原子、分子、中子;带正电的粒子:阳离子、质子;带负电的粒子:阴离子、电子。
2、等质量金属跟足量酸反应,放出氢气由多至少的顺序按相对原子质量/化合价由小到大排列:Al(9)>Mg(12)>>Fe(28)>Zn(32.5)
④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应,
**复分解反应前后各元素和原子团的化合价都保持不变。
**注意事项:复分解反应能否发生,要考虑是否有沉淀、气体或水生成。有沉淀生成的反应中,反应物中不能有难溶于水的物质。初中化学只有碳酸盐跟酸反应和碱溶液与铵盐反应有气体生成
中和反应:酸跟碱作用生成盐和水的反应。中和反应属于复分解反应。
4. 化学反应基本类型
①化合反应:A+B+...=C 多变一的反应 (符合绿色化学要求)
②分解反应:A=B+C+... 一变多的反应
**分解反应前后元素的化合价发生改变。
③置换反应:A+BC=AC+B 一单换一单的反应
**溶液里的置换反应必须符合金属活动性顺序:
金属活动性顺序由强至弱: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(按顺序背诵) 钾钙钠镁铝 锌铁锡铅(氢) 铜汞银铂金
*金属位置越靠前的活动性越强,越易失去电子变为离子,反应速率越快
*排在氢前面的金属能置换酸里的氢,排在氢后的金属不能置换酸里的氢,跟酸不反应;
*排在前面的金属,能把排在后面的金属从它们的盐溶液里置换出来。排在后面的金属跟排在前面的金属的盐溶液不反应。
注意:1、单质铁在置换反应中总是变为+2价的亚铁
3.物质的分类
 金属单质
金属单质
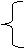
 物
混合物 单质 非金属单质 酸性氧化物
物
混合物 单质 非金属单质 酸性氧化物
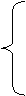
 物质种类
稀有气体
氧化物
物质种类
稀有气体
氧化物
 质 纯净物 元素种类
酸
碱性氧化物
质 纯净物 元素种类
酸
碱性氧化物
 化合物 无机物
碱
化合物 无机物
碱
有机物 盐
①混合物与纯净物的区分:物质的种类。由一种物质组成的是纯净物;是由两种或两种以上的物质混合而成(或由不同种物质组成)是混合物。
例如:水、 水银、 蓝矾(CuSO4 ·5H2 O)都是纯净物。冰与水混合是纯净物。 名称中有“某化某”“某酸某”的都是纯净物,是化合物。
例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水), 矿物(煤、石 油、天然气、铁矿石、石灰石),合金(生铁、钢)是混合物。
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。硫酸是纯净物,盐酸是混合物。
纯净物、混合物与组成元素的种类无关。即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
②单质与化合物的区分:元素的种类。由同种(或一种)元素组成的纯净物叫单质;由不同种(两种或两种以上)元素组成的纯净物。名称中有“某化某”“某酸某”的是化合物。
③有机物与无机物的区分:是否含有碳元素。有机物含碳元素的化合物(除CO、CO2 和含碳酸根化合物外)无机物:不含碳元素的化合物以及CO、CO2 和含碳酸根的化合物。
注意:最简单的有机物是甲烷。
④氧化物:由两种元素组成,其中一种是氧元素的化合物。
a.酸性氧化物:跟碱反应生成盐和水的氧化物。CO2,SO2,SO3大部分非金属氧化物都是酸性氧化物,跟水反应生成同价的含氧酸。CO2 + H2O= H2CO3 SO2 + H2O= H2SO3 SO3 + H2O= H2SO4
b.碱性氧化物:跟酸反应生成盐和水的氧化物。大部分金属氧化物都是碱性氧化物,BaO K2 O CaO Na2 O溶于水立即跟水反应生成相应的碱,其他碱性氧化物不溶于水跟水不反应。CaO+H2O=Ca(OH)2 BaO+H2O=Ca(OH)2 Na2O+H2O=2NaOH K2O+H2O=2KOH
c.注意:CO和H2 O既不是酸性氧化物也不是碱性氧化物,是不成盐氧化物。
⑤酸:电离时生成的阳离子全部是氢离子的化合物。酸溶液的PH值小于7
酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”,酸由氢和酸根离子组成
紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色
根据酸的组成,通常有以下两种分类方法:
 a.根据酸分子电离所能生成的氢离子的个数分为:一元酸(HCl、HNO3 )、
a.根据酸分子电离所能生成的氢离子的个数分为:一元酸(HCl、HNO3 )、
二元酸(H2 SO4 、H2 S、H2 CO3 )和三元酸(H3 PO4 )
b.根据酸分子里有无氧原子分为:
 含氧酸(H2 SO4
,HNO3 , H3 PO4 名称为:某酸)
含氧酸(H2 SO4
,HNO3 , H3 PO4 名称为:某酸)
无氧酸(HCl, H2 S名称为:氢某酸 )
鉴定酸(鉴定H+ )的方法有:①加紫色石蕊试液变红色的是酸溶液;②加活泼金属Mg、Fe、Zn等有氢气放出
⑥.碱:电离时生成的阴离子全部是氢氧根离子的化合物。碱通常由金属离子和氢氧根离子构成
*溶碱有五种:钾钙钠钡氨(KOH、Ca(OH)2、NaOH、Ba(OH)2、氨水)它们的溶液无色。
*有颜色的碱(不溶于水):红褐色的氢氧化铁(Fe(OH)3↓)、蓝色的氢氧化铜(Cu(OH)2↓)其他固体碱是白色。碱的名称通常有“氢氧化某”,化学式的最后面是“OH”
*可溶性碱的溶液PH值大于7,紫色石蕊试液遇溶碱变蓝色,无色酚酞试液遇溶碱变红色
*鉴定可溶性碱溶液(鉴定OH-)方法一:加紫色石蕊试液变蓝色,加无色酚酞试液变红色是碱.
方法二:加铁盐溶液有红褐色沉淀生成;加铜盐溶液有蓝色沉淀的是碱。
⑦.盐:电离时生成金属离子和酸根离子的化合物。无氧酸正盐叫 “某化某”、含氧酸盐叫“某酸某”按盐中相同部分的离子称为某类盐:含碳酸根离子的盐称为碳酸盐、含硫酸根离子的盐称为硫酸盐、含硝酸根离子的盐称为硝酸盐、含铁离子的盐称为铁盐,等等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com